Рак легкого является одним из наиболее распространенных злокачественных опухолей в мире с самой высокой заболеваемостью и смертностью. В России ежегодно раком легкого заболевают более 60 тыс. человек. Среди мужчин каждый четвертый больной со злокачественной опухолью – это больной раком легкого. К моменту установления диагноза более 75 % всех больных раком легкого имеют местно-распространенный или метастатический процесс. Немелкоклеточный рак легкого (НМРЛ – плоскоклеточный рак, аденокарцинома, крупноклеточный рак) составляет 80–85 % от всех форм рака легкого [1, 2].
Цель исследования – обобщить данные собственных результатов по органосохранным операциям выполненным авторами при немелкоклеточном раке легкого, сочетающихся с пластикой легочной артерии и бронхов.
Ведущим радикальным методом лечения немелкоклеточного рака легкого остаётся хирургический [3]. В настоящее время при местнораспространенном опухолевом процессе все чаще выполняются органосохраняющие хирургические вмешательства с реконструктивно-пластическим компонентом.
Материал и методы исследования
В Томском НИИ онкологии за период с 2010 по 2015 гг. выполнено 9 органосохранных операций в объеме лобэктомии с резекцией и реконструкцией легочной артерии.
Мужчин было 8 (88,9 %), женщин 1 (11,1 %). Средний возраст больных составил 56,4 ± 7,29 лет. Больные были распределены по стадиям заболевания следующим образом: T3N0M0 – 3 пациента (33,3 %), T3N1M0 – 4 больных (44,4 %), T3N2M0 – 2 больных (22,2 %). При этом 2 больных наблюдались с диагнозом ПМЗО: синхронный рак I стадии T1N0M0 в\долевого бронха справа и метахронный рак н\доли правого легкого.
Результаты исследования и их обсуждение
Наиболее распространенной (77,8 %) морфологической формой рака легких у больных был плоскоклеточный рак – 7 пациентов, наименьшее распространение имела аденокарцинома – 2 больных (22,2 %). По степени дифференцировки распределение было следующим: большинство опухолей имели умеренную степень дифференцировки – 5 (55,6 %), 4 – низкодифференцированный рак (44,4 %). Пациентам была выполнена органосохранная операция с резекцией и реконструкцией ЛА в радикальном объеме. Из них 8 лобэктомий – 88,9 % и 1 би-лобэктомия – 11,1 %. 5 пациентов получали курсы предоперационной химиотерапии, из них 4 по схеме винорелбин-карбоплатин (частичная регрессия у 2 больных, стабилизация – у 2 больных), 1 – паклитаксел-карбоплатин (стабилизация процесса). 4 других пациентов получали послеоперационное химиолучевое лечение.
В большинстве случаев вмешательство на легочной артерии было необходимо при локализации рака в верхней доле левого легкого. Это еще раз подтверждает, что возможность инвазии легочной артерии выше при локализации слева в верхней доле, вследствие особенностей ее анатомии и близости структур. Правое верхнедолевое поражение наблюдалось у 1 пациента.
Анализируя данные по клинико-анатомической форме рака, мы получили, что чаще ЛА поражается при центральной форме РЛ – 5 (55,6 %), на периферический рак приходится 44,4 % (n = 4).
Самым частым видом резекции ЛА явилась краевая 5 (55,6 %), которая не потребовала пластики дополнительными материалами и ограничилась ушиванием дефекта. Циркулярных резекций легочной артерии было 3 (33,3 %), восстановление непрерывности осуществлялось с помощью ручного анастомоза по типу конец-в-конец. В 1 (11,1 %) случае после краевой резекции ввиду большого дефекта потребовалось вшивание заплаты. У 3 пациентов одновременно с ангиопластикой выполнялась резекция и реконструкция бронха: в 2 случаях выполнена клиновидная резекция бронха, в одном случае краевая резекция левого главного бронха. Послеоперационные осложнения наблюдались у 1 (11,1 %) пациента после лобэктомии контрлатерального легкого в анамнезе, который подробно представлен в клиническом случае. Летальности отмечено не было.
Прослежены отдаленные результаты лечения: 6 пациентов наблюдаются без признаков прогрессирования, из них 2 больных – в течение 48 месяцев, по 1 больному – 36, 24, 9 и 4 месяца соответственно. У 3 больных выявлено прогрессирование за счет отдаленного метастазирование на сроках 4, 6 и 9 месяцев. Местный рецидив в нашем наблюдении не выявлен.
Представляем клинический случай. Пациент Е. 1947 г.р., считает себя больным с января 2008 года, когда появился кашель с трудно отходящей мокротой, одышка при умеренной физической нагрузке. Пациенту проведено комплексное обследование, по результатам которого выявлен центральный рак верхнедолевого бронха справа. В марте 2008 выполнена операция верхняя лобэктомия справа с ипсилатеральной лимфодиссекцией. Послеоперационный период протекал без особенностей. По данным гистологического заключения плоскоклеточный рак умеренной степени дифференцировки, экзофитная форма роста без метастазов в лимфоузлы. Таким образом, установлена I стадия процесса T1N0M0, адъювантное лечение не показано. Далее пациент проходил контрольные обследования в условиях Томского НИИ онкологии согласно срокам диспансерного наблюдения.
В феврале 2015 года появились жалобы на общую слабость, одышку смешанного характера при умеренной физической нагрузке, повышение температуры тела, кашель с тяжело отделяемой мокротой зеленого цвета. При дообследовании (СКТ ОГК) выявлено мягкотканное образование в прикорневой зоне S1-2 слева с неровными, бугристыми, местами тяжистыми контурами, размерами 5,7 х 4,7 х 5,8 см; медиальный контур опухоли достигал корня и инфильтрировал верхнедолевой бронх до уровня главного, легочную артерию до и после отхождения верхнедолевой ветви. Также было выявлено; что легочная ткань эмфизематозная с наличием множества участков буллезного вздутия и выраженными участками локального и диффузного пневмофиброза. При видеобронхоскопии бронхи S1-3 слева полностью выполнены ярко-розовой тканью с некрозом; справа культя верхнедолевого бронха без признаков рецидива. При морфологическом исследовании биопсийного материала получены данные за умеренно дифференцированный плоскоклеточный неороговевающий рак с некрозом. Пациент был обследован по соматическому статусу, проведено комплексное обследование состояния кардиореспираторной системы (ЭКГ, ЭХО-КГ, xолтеровское мониторирование, пробы с нагрузкой, функция внешнего дыхания) и оценка нутритивного статуса. Из сопутствующих заболеваний выявлена выраженная обструктивная болезнь легких, хронический бронхит курильщика (с 40-летним анамнезом).
По данным исследования функции внешнего дыхания нарушение вентиляции по обструктивному типу II-III степени, ЖЕЛ 98 %, ОФВ1 = 66 %, индекс Тиффно 67 %, проба с бронхолитиком отрицательная.
Был сформулирован следующий клинический диагноз: Первично-множественные злокачественные новообразования, метахронный рак: 1) Центральный рак верхнедолевого бронха справа I стадия T1N0M0. Состояние после верхней лобэктомии справа от 12.03.2008. 2) Центральный рак верхнедолевого бронха слева с инфильтрацией легочной артерии IIb стадия T3N0M0. С учетом распространенности процесса решено было в плане комбинированного лечения провести курсы полихимиотерапии (ПХТ).
В период 02.07.15-15.10.15 проведено 6 курсов ПХТ по схеме карбоплатин / паклитаксел, лечение перенес удовлетворительно, без побочных реакций. По данным контрольного обследования эффект лечения расценен как частичная регрессия, СКТ ОГК слева во втором сегменте сохраняется инфильтрация легочной артерии на прежнем протяжении, опухоль же уменьшилась в размерах до 35х33 мм в диаметре.
Повторно оценивалась ФВД, при которой в сравнении с исследованиями от существенной динамики не отмечено. С учетом ранее перенесенной операции верхней лобэктомии справа, буллезной эмфиземы легких, выраженного двустороннего пневмофиброза и вентиляционных нарушений II-III степени оперативное лечение в объеме пневмонэктомии слева было абсолютно противопоказано.
Исходя из этих данных решено выполнить реконструктивно-пластическую операцию верхнюю лобэктомию слева с резекцией и пластикой легочной артерии и медиастинальной лимфодиссекцией.
26.11.15 операция, доступ боковая торакотомия в IV межреберье слева. Верхняя доля в ателектазе, плевральная полость тотально облитерирована. Выполнен пневмолиз тупым и острым путем. При ревизии – диссеминации процесса по плевре нет, опухоль пальпаторно в проекции верхнедолевого бронха до 3 см в диаметре, в процесс вовлечена легочная артерия, в нижней доле булла до 6 см. Рассечена легочная связка. Выполнена медиастинотомия. Выделена, перевязана и пересечена верхняя легочная вена. Разделение паренхимы между S2 и S6 по междолевой борозде с использованием аппаратного шва (УО-60). Верхнедолевой бронх прошит аппаратом УО-30, пересечен, культя дополнительно ушита отдельными узловыми швами.
Лимфодиссекция средостения и зоны аортального окна. Далее мобилизован верхнедолевой сегмент легочной артерии, выявлено, что опухоль врастает в стенку сосуда по его латеральной стенке на участке до 3 см. На основной ствол и чуть ниже отхождения VI сегментарной артерии наложены сосудистые зажимы. Опухоль иссечена в пределах здоровых тканей по длиннику до 4 см и на 2/3 окружности сосуда, верхняя доля удалена. Пластика образовавшегося дефекта выполнена в виде заплаты длиной 6 см с помощью сосудистого протеза из полиэфирного трикотажа с коллагеновым покрытием POLYMAILLE. Протез вшит в стенку артерии непрерывным швом PROLENE 5-0. Сверху протез укрыт пластинами «Тахокомб» с гемостатической целью. Иссечена булла нижней доли с помощью УО-60.
Контроль на гемостаз, аэростаз, инородные тела. Послойное ушивание раны с оставлением 2 силиконовых дренажей.
По данным послеоперационной гистологии – плоскоклеточный рак умеренной степени дифференцировки с некрозом опухолевой ткани с лечебным патоморфозом 1 степени, прорастание стенки легочной артерии, по границам резекции опухолевой ткани не обнаружено.
Послеоперационный период осложнился развитием острого респираторного дистресс-синдрома, острой дыхательной недостаточностью, которые потребовали выполнения верхней трахеостомии для проведения длительной ИВЛ во вспомогательном режиме. В дальнейшем присоединилась нозокомиальная двусторонняя тяжелая пневмония, ассоциированная с ИВЛ, двусторонний реактивный экссудативный плеврит. По поводу указанных осложнений пациент получал комплексную медикаментозную терапию, включающую антибиотикотерапию (эмпирически и на основании бактериального посева мокроты с определением чувствительности к антибиотикам), противовоспалительную, дезинтоксикационную, бронхолитическую, иммуномодулирующую и оксигенотерапию с положительным клиническим эффектом. Неоднократно проводились санация бронхиального дерева посредством бронхоскопии с удалением вязкого бронхиального секрета. Контрольная СКТ органов грудной клетки, выполненная 27.11.15 г. – ветви легочной артерии слева хорошо контрастированы, деформированы и дислоцированы; признаков тромбоза и тромбоэмболии нет рис. 2, (a-г).
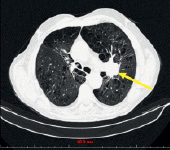
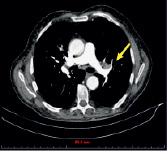
а) б)
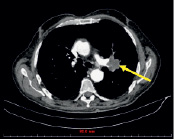
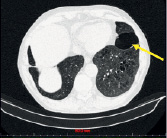
в) г)
Рис. 1. (a-г) Пациент Е., 69 лет. Данные спиральной компьютерно томографии органов грудной клетки. Опухоль (показана стрелкой) расположена в развилке верхне- и нижнедолевого бронхов слева (a), распространяется на нижнедолевой бронх, вероятно на главный (б), обтурирует язычковые бронхи, инфильтрирует нижнюю легочную вену, левую ветвь легочной артерии и все долевые. Предоперационная СКТ больного Е., 69 лет. Риснок в – инвазия опухолевого узла в легочную артерию и бронх.; г – булла в нижней доле левого легкого до 6 см
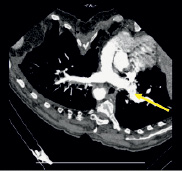
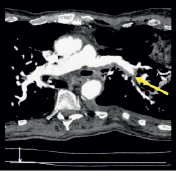
а) б)
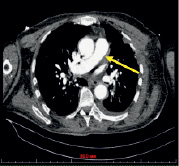
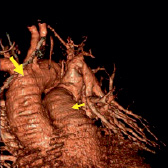
в) г)
Рис. 2. (a-г). Результаты результирующего органосохраняющего вмешательства. Контрольные СКТ томограммы на уровне легочного ствола, правой и левой легочной артерии. Легочные артерии проходимы, данных за пристеночный тромбоз нет. Рис. а, б – проходимость легочной артерии на уровне деления ствола; в – на уровне восходящего и нисходящего отделов дуги аорты, г – трехмерная реконструкция в цвете легочного ствола (маленькая стрелка) и дуги аорты (большая стрелка) после вмешательства (подробные объяснения в тексте)
Состояние пациента оставалось тяжелым обусловленное дыхательной недостаточностью. На фоне проводимых лечебных мероприятий 05.01.16 пациент переведен на самостоятельное дыхание на фоне ингаляции увлажненного кислорода, а 26.01.16 больной выписан из клиники в состоянии, ближе удовлетворительному.
Данный клинический случай наглядно демонстрирует эффективность проведенной органосохранной операции при изначально низких функциональных показателях, выраженной ХОБЛ с пневмофиброзом и буллезной эмфиземой у пациента с крайней степенью хирургического риска, ранее уже перенесшего хирургическое лечение по поводу рака легкого. С учетом ранее выполненной верхней лобэктомии справа, исчерпывающих возможностей консервативного (химиотерапевтического) лечения, невозможности проведения лучевой терапии по причине инвазии легочной артерии и высокого риска возникновения аррозивного кровотечения, то данная операция – единственный вариант противоопухолевого лечения для данного пациента.
Заключение
Ангиопластические операции при раке легкого впервые были предложены Allison в 1954 г. В 1967 г. Wurning описал технику краевой резекции легочной артерии, а годом позже, методику циркулярной резекции [7]. Спустя несколько лет Pichlmayer и Spelsberg опубликовали 4 успешных случая циркулярной резекции легочной артерии. Vogt-Moykopf в 1986 году представил результаты 37 циркулярных резекций легочной артерии (ЛА). Продемонстрировано, что операция была выполнима с приемлемыми осложнениями и хорошей долгосрочной выживаемостью [7, 13].
В настоящее время опубликованы данные нескольких ретроспективных исследований и мета-анализов, доказывающих, что лобэктомия с циркулярной резекцией ЛА и/или бронхов представляет собой адекватный лечебный вариант при центральном раке легкого, который позволяет снизить смертность, связанную с пневмонэктомией не в ущерб онкологической радикальности. Качество жизни в послеоперационном периоде также выступает одним из наиболее значимых показателей, которые должны повлиять на решение выполнить органосохранную операцию вместо пневмонэктомии [4, 5, 14, 15].
Легочная артерия может быть инфильтрирована первичной опухолью легкого, метастатическими лимфоузлами с экстракапсулярным распространением, либо метастатическими опухолями легких. Правая и левая легочные артерии могут быть инфильтрированы на различном протяжении от краевого до циркулярного поражения. Наиболее часто поражается центральная часть левой легочной артерии, что связано с ее анатомическим расположением относительно верхнедолевого бронха [13]. С помощью ангиографии, компьютерной томографии, и МРТ возможно оценить степень инвазии ЛА, однако решение о пластике обычно принимается во время операции [7, 10, 13]. В случае ограниченной инфильтрации артериальной стенки простая краевая резекция с ушиванием может быть достаточной для радикального иссечения. Реконструкция более крупных дефектов (вплоть до 30 % или 40 % от диаметра окружности) может быть выполнена при помощи заплаты (из биологического или синтетического материала). Большая и расширенная инфильтрация требует выполнения циркулярной резекции и реконструкцию ЛА с помощью анастомоза по типу конец-в-конец либо посредством протеза [5, 9, 11].
Различные материалы могут быть использованы для заплаты, в том числе синтетические или биологические, причем последние являются предпочтительными из-за более высокой биосовместимости. Среди биологических материалов некоторые авторы рекомендуют использовать собственный перикард так как он имеет ряд преимуществ: обладает адекватной толщиной и сопротивлением, имеет превосходную биосовместимость по сравнению с бычьим перикардом. Кроме того, собственный перикард можно иссечь в необходимом количестве, которое может потребоваться для восстановления больших дефектов; возможна реконструкция после проведения индукционной терапии [6, 7].
В случае поражения ½ окружности ЛА или больше, требуется выполнение циркулярной резекции. Несоответствие калибра сшиваемых концов сосуда обычно не представляет технических сложностей, даже после предоперационной терапии, при которой снижается эластичность сосудистой стенки. Пациентам, которым одномоментно выполняется бронхопластика, реконструкция ЛA как правило проводится в последнюю очередь, потому что манипуляции на бронхе выполняются значительно легче, когда артерия рассечена. После завершения бронхиального анастомоза бронхиальное дерево сокращается, тем самым уменьшается напряжение на сосудистый анастомоз [6, 13].
У некоторых пациентов после циркулярной резекции ЛА образуется чрезмерное расстояние между 2 сосудистыми концами, в этих случаях ангиопластика не может быть осуществлена путем прямого анастомоза конец-в-конец, поэтому используется протезная вставка. В данном случае успешно применяется аутологичный и бычий перикард. Альтернативой для реконструкции является легочная вена резецированной доли, свободная от опухоли [5, 9]. Криоконсервированные аллотрансплантаты для ангиопластики ЛА были также успешно применены другими исследователями [4]. Возможно и использование сосудистых протезов из полифтортертраэтилена (ПТФЭ) [7, 12, 13].
Поражение основного ствола ЛА (T4 инвазия по классификации TNM) требует реконструкции с использованием аорто-коронарного шунтирования [13].
Конечный результат реконструктивно-пластических операций на бронхах и ЛА зависит главным образом от тщательной хирургической техники. В целом, послеоперационные осложнения встречаются в 12-28 % случаев. Однако технические осложнения редки и составляют менее 2 %. Проведение неоадъювантной химиотерапии, как правило, не увеличивает риск осложнений после ангиопластических операций при раке легкого [6, 9, 15].
Возникновение бронхоартериального свища, который является редкими катастрофическим осложнением, может быть предотвращено с использованием васкуляризированного мышечного лоскута, особенно в случаях бронхопластических операций [6].
Послеоперационное кровотечение может быть связано с подтеканием крови из линии сосудистого анастомоза, поскольку ЛА является сосудом с низким давлением, кровотечение из линии шва может быть не выявлено во время операции, но это может произойти позже, после расправления легкого и из-за поворота ЛА по оси. Этот поворот может исказить линию шва и кровотечение может возникнуть через несколько часов после ушивания грудной клетки [6]. Поскольку химиотерапия и лучевая терапия уменьшают эластичность легочной паренхимы, расправление остаточной доли легкого после индукционной терапии иногда происходит медленнее, чем в стандартных случаях [6]. Такие явления могут объяснить неожиданные кровотечения, начиная со второго или третьего дня после операции со спонтанным разрешением в пределах от 24 до 48 часов. Тщательный интраоперационный гемостаз в области линии швов даже после повторного раздувания легкого может помочь уменьшить риск этого осложнения [6].
Поворот нижней доли после пластики ЛА может также способствовать возникновению тромбоза из-за перегибов и перекрутов легочной артерии. Тем не менее, тромбоз представляет собой редкое осложнение в случае циркулярной резекции или пластикой ЛА с помощью заплаты, менее чем в 2 % случаев [6].
Анализируя данные литературы, периоперационная смертность составляет меньше 2,5 % в большинстве опубликованных статей [8, 10, 15].
Библиографическая ссылка
Миллер С.В., Волков М.Ю., Родионов Е.О., Тузиков С.А., Евтушенко В.В., Лукьяненок П.И., Евтушенко А.В. ОПЫТ АНГИОПЛАСТИЧЕСКИХ ОПЕРАЦИИ ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО // Международный журнал прикладных и фундаментальных исследований. 2016. № 6-2. С. 263-269;URL: https://applied-research.ru/ru/article/view?id=9593 (дата обращения: 03.03.2026).
DOI: https://doi.org/10.17513/mjpfi.9593

