Создание качественных, эффективных и безопасных лекарственных средств (ЛС) является основной задачей современной фармацевтической науки и практики. Любая национальная фармакопея устанавливает стандарты качества ЛС данной страны, являясь наглядным индикатором уровня развития и состояния национальной фармацевтической науки и промышленности. Отечественная система стандартизации ЛС базируется на Государственной Фармакопее Российской Федерации (ГФ РФ), включающей в себя общие фармакопейные статьи (ОФС) и фармакопейные статьи (ФС). Согласно Федеральному Закону № 61-ФЗ «Об обращении лекарственных средств» от 12 апреля 2010 года «качество лекарственного средства – это соответствие лекарственного средства требованиям фармакопейной статьи, либо в случае её отсутствия нормативной документации или нормативного документа» [1]. Требования ГФ обязательны для всех организаций, занимающихся на территории РФ производством, изготовлением, хранением и применением лекарственных средств. Статьи ГФ РФ используются предприятиями – производителями лекарственных средств, как основа для создания собственной нормативной документации, которая в последующем применяется в экспертизе и контроле качества лекарственных средств на всех этапах их жизненного цикла [2].
В настоящее время, в соответствии с Государственным Реестром лекарственных средств (ГРЛС РФ), в Российской Федерации зарегистрировано более 50 препаратов пробиотиков, представленных в различных лекарственных формах (ЛФ) [3]. Увеличение номенклатуры пробиотиков потребовало создания фармакопейных стандартов качества и унификации требований, предъявляемых к их структуре и содержанию.
Целью данного исследования явилось создание фармакопейных стандартов качества лекарственных препаратов пробиотиков, основанных на современных научных достижениях и требованиях отечественных регламентирующих документов. В зарубежных фармакопеях данная группа лекарственных препаратов не выделена в категорию ЛС и монографии на них отсутствуют. В связи с этим, проведение анализа аналогичных монографий ведущих зарубежных фармакопей не представлялось возможным.
Разработка ОФС на лекарственные пробиотики и методы их анализа требовала решения нескольких задач:
– унификация используемых терминов и создание системы классификации на группы препаратов (т.к. без унификации терминологической системы невозможно однозначное понимание регламентируемых стандартов и положений);
– анализ требований, предъявляемых к показателям качества, нормативным требованиям, методам и методикам, условиям проведения испытаний препаратов пробиотиков.
Несмотря на давность введения термина «пробиотики» [4] до настоящего времени продолжаются научные дискуссии, касающиеся правомерности его применения наряду с термином, также используемым в нашей стране – «эубиотики» (или «бактерийные препараты нормофлоры»). Под термином «пробиотик» понимают «препарат на основе живых и убитых микроорганизмов и веществ микробного происхождения, оказывающих позитивные эффекты на физиологические, биохимические и иммунные реакции организма хозяина через стабилизацию и оптимизацию функции его нормальной микрофлоры» [5]. «Эубиотики – это бактерийные препараты, действующим началом которых являются живые культуры микроорганизмов – представителей нормальной микрофлоры» [6]. Таким образом, терминами «пробиотики» и «эубиотики» изначально обозначали лекарственные препараты, содержащие бактерии, входящие в состав нормальной микрофлоры человека. На протяжении последних лет данные термины использовались как синонимы. Это объясняется тем, что в состав подавляющего большинства пробиотиков изначально входили бактерии нормальной микрофлоры человека. Вместе с тем, понятие «пробиотики» более широкое. В настоящее время в состав препаратов пробиотиков входят бациллы, энтерококки, грибы, в связи, с чем использование по отношению к их наименованию понятия «пробиотик» правильнее. Эубиотики, по своей сути согласно современным представлениям, следует рассматривать как частную разновидность пробиотиков, поэтому в ОФС, включенной в ГФ РФ XIII издания, используется термин «пробиотики для медицинского применения» с указанием о том, что пробиотики содержат живые и инактивированные апатогенные микроорганизмы и/или продукты их метаболизма вместе с частично разрушенными микробными клетками, обладающими антагонистической активностью в отношении патогенных и условно-патогенных бактерий и обеспечивающими восстановление нормальной микрофлоры человека [7].
Традиционно пробиотики классифицируют на группы по составу или по названию таксономических групп микроорганизмов.
По составу пробиотики подразделяют на монокомпонентные, поликомпонентные, сорбированные и комбинированные. Система классификации основана на содержании в составе в качестве активного компонента одного («моно») или нескольких («поли») штаммов/видов/родов микроорганизмов; вспомогательных веществ сорбентов – активированный угль, кремния диоксид коллоидный и т.п.), (в этом случае пробиотик называется «сорбированным») или лизоцима, лекарственных средств растительного происхождения, витаминов/микроэлементы и др. (такой пробиотик называется комбинированным). Основные недостатки этой классификации состоят в том, что препараты, входящие в одну группу отличаются по основным показателям («Подлинность», «Специфическая активность», «Количество живых бактерий в одной дозе» и «Отсутствие посторонних микроорганизмов и грибов»/«Микробиологическая чистота») и нормативным требованиям. Например, в группу «монокомпонентных пробиотиков» входят препараты Бифидумбактерин и Споробактерин, у которых разные показатели специфической активности, в первом случае «Активность кислотообразования», а во втором – «Антагонистическая активность». Кроме того показатели качества «Количество живых бактерий в одной дозе» и «Отсутствие посторонних микроорганизмов и грибов/Микробиологическая чистота» также контролируют разными методами, т.к. данные препараты содержат анаэробные и аэробные бактерии, которые требуют различных условий культивирования.
Другая система классификации основана на делении по таксономическим группам микроорганизмов: «бифидосодержащие пробиотики», «лактосодержащие пробиотики», «колисодержащие пробиотики», «споровые пробиотики» и «пробиотики других таксономических групп (содержат живые апатогенные бактерии, принадлежащие к родам Leuconostoc, Pediococcus, Propionibacterium, Aerococcus, Enterococcus, дрожжевых грибов – Saccharomyces сerevisiae и S.boulardii)». Этой системой классификации учитываются основные свойства активного компонента. Препараты, входящие в одну группу не отличаются по показателям качества, отличия в нормативных требованиях незначительны. В связи с этим система деления по таксономическим группам микроорганизмов была взята за основу. Для четырех групп пробиотиков были разработаны общие фармакопейные статьи [7].
Требования к перечню показателей качества, включаемых в фармакопейную статью и/или нормативную документацию на лекарственные препараты, складывается из требований к лекарственной форме, в которой данный препарат выпускается, и биологических свойств активного компонента. Для создания единой системы оценки качества пробиотиков (отечественных и зарубежных) были проанализированы требования нормативной документации на препараты, внесенные в ГРЛС РФ [3]. Проведенный анализ показал, что пробиотики применяются с использованием различных путей введения: для приема внутрь, интравагинально, ректально. При этом они препараты пробиотиков могут быть в виде различных ЛФ (лиофилизаты, суспензии, порошки, таблетки, ректальные и вагинальнын суппозитории и др.). Показатели качества, включенные в ОФС на пробиотики [7], с соответствующими ссылками на ОФС представлены в табл. 1.
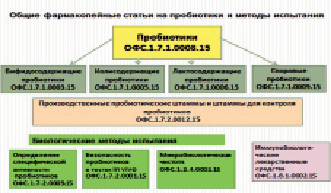
Схема распределения общих фармакопейных статей на препараты пробиотиков и методы испытаний, включенные в ГФ РФ, изд. XIII [7]
Таблица 1
Показатели качества и методы их определения, включенные в общие фармакопейные статьи [7]
|
Название показателя |
Ссылка на нормативный документ или метод испытания |
|
Описание |
Визуальный |
|
Подлинность |
ОФС.1.7.2.0009.15 «Определение специфической активности пробиотиков» |
|
Время восстановления (для лиофилизатов, порошков) |
ОФС.1.8.1.0002.15 «Иммунобиологические лекарственные средства» |
|
Время распадаемости (для таблеток и капсул) |
ОФС1.4.2.0013.15 «Распадаемость таблеток и капсул» |
|
Температура и время плавления или время полной деформации (для суппозиториев) |
ОФС.1.2.1.0012.15 «Температура плавления» или ОФС1.4.2.0010.15 «Определение времени полной деформации суппозиториев на липофильной основе» |
|
рН |
ОФС.1.2.1.0004.15 «Ионометрия» |
|
Потеря в массе при высушивании |
ОФС.1.2.1.0010.15 «Потеря в массе при высушивании» |
|
Средняя масса и отклонения от средней массы (для таблеток, суппозиториев, содержимого капсул, пакетов) |
ОФС.1.4.2.0009.15 «Однородность массы дозированных лекарственных форм» |
|
Извлекаемый объем (для суспензий) |
ОФС.1.4.2.0002.15 «Извлекаемый объем» |
|
Специфическая безвредность |
ОФС.1.7.2.0001.15 «Безопасность пробиотиков в тестах in vivo» |
|
Отсутствие посторонних микроорганизмов и грибов |
ОФС.1.2.4.0002.15 «Микробиологическая чистота» |
|
Специфическая активность |
ОФС.1.7.2.0009.15 «Определение специфической активности пробиотиков» |
|
Производственные штаммы и штаммы для контроля |
ОФС.1.7.2.0012.15 «Производственные пробиотические штаммы и штаммы для контроля пробиотиков» |
|
Упаковка и Маркировка |
ОФС.1.8.1.0002.15 «Иммунобиологические лекарственные средства» |
|
Хранение |
ОФС.1.8.1.0002.15 «Иммунобиологические лекарственные средства» |
Контроль обязательных показателей качества пробиотиков «Подлинность», «Специфическая активность», «Отсутствие посторонних микроорганизмов и грибов» и «Специфическая безвредность» включает в себя биологические и микробиологические методы, которые характеризуются более высокой степенью вариабельности, чем физико-химические, что явилось необходимостью к разработке общих фармакопейных статей на используемые методы испытаний.
ОФС 1.7.2.0009.15 «Определение специфической активности пробиотиков» вводится впервые и включает валидированные методы определения показателей качества «Количество жизнеспособных бактерий в одной дозе лекарственного средства», «Активность кислотообразования» или «Антагонистическая активность». Определение количества живых особей в дозе проводят методом десятикратных разведений с высевом на плотные питательные среды (метод Коха) и глубинного чашечного метода или в жидкие и полужидкие среды (метод предельных разведений). При проведении контроля поликомпонентных или комбинированных пробиотиков необходимо учитывать количество и соотношение всех видов или штаммов входящих в препарат. Результаты количественного определения микроорганизмов выражаются в колониеобразующих единицах (КОЕ). Кислотообразующую активность штаммов-продуцентов, входящих в лакто- и бифидосодержащие пробиотики определяют по титруемой кислотности при культивировании бактерий в адекватной питательной среде, методом кислотно-основного титрования. Для определения антагонистической активности используют метод отсроченного антагонизма на плотной среде по зонам задержки роста тест-штаммов патогенных и условно-патогенных микроорганизмов. Тест-штаммы микроорганизмов, получают из Государственной коллекции патогенных микроорганизмов ФГБУ «НЦ ЭСМП» Министерства здравоохранения РФ (если нет других указаний в фармакопейной статье или нормативной документации).
ОФС.1.7.2.0001.15 «Безопасность пробиотиков в тестах in vivo» вводится впервые и содержит валидированные биологические методы, используемые в опытах in vivo, предназначенные для определения следующих показателей: «Безвредность», «Вирулентность», «Токсичность», «Токсигенность», позволяющих выявлять недопустимые реакции человеческого организма на применение лекарственного средства и отсутствие риска причинения вреда здоровью. Контроль пробиотика по показателю «Безвредность» позволяет выявить негативное воздействие испытуемого препарата при вероятном образовании токсических примесей (например, при нарушении производственного регламента, нарушениях условий хранения и т.п.). Испытание безвредности препарата пробиотика осуществляют при его пероральном введении беспородным белым мышам в количестве, не превышающем одной человеческой дозы. Показатели «Вирулентность», «Токсичность» и «Токсигенность» являются обязательными при контроле безопасности производственных штаммов бактерий рода Escherichia coli, Bacillus, Leuconostoc, Pediococcus, Propionibacterium, Aerococcus, Enterococcus, дрожжевых грибов – Saccharomyces сerevisiae, S.boulardii и др. микроорганизмов. Целью проведения данных тестов является выявление возможной патогенности испытуемых штаммов, превышающей установленный ранее допустимый уровень, что может контролироваться по летальности или интоксикации тестируемых животных.
В ОФС.1.2.4.0002.15 «Микробиологическая чистота» впервые включен раздел «Определение микробиологической чистоты иммунобиологических лекарственных средств, содержащих живые микроорганизмы», в котором впервые указаны категории микробной чистоты различных ЛФ пробиотиков (табл. 2), методы определения отсутствия контаминации препаратов пробиотиков посторонними микроорганизмами и грибами.
Таблица 2
Микробиологическая чистота пробиотиков
|
ПРОБИОТИКИ |
Категория 5.3 |
|
ЛФ |
Рекомендуемые требования |
|
А. Для приема внутрь, интравагинально (лиофилизаты, суспензии, порошки) |
– Отсутствие бактерий-контаминантов в единице препарата/г(мл) – Отсутствие дрожжевых и плесневых грибов в единице препарата/г(мл) – Для колисодержащих препаратов – отсутствие в единице препарата/г(мл) БОЕ бактериофага (для препаратов с содержанием E.coli не менее 1010 КОЕ допускается не более 10 БОЕ бактериофага) |
|
Б. Для приема внутрь, интравагинально, ректально (таблетки, капсулы, суппозитории) |
– Общее число аэробных бактерий – не более 102 КОЕ в единице препарата (г) – Общее число дрожжевых и плесневых грибов – менее 10 КОЕ в единице препарата (г) – Отсутствие энтеробактерий в единице препарата (г) – Отсутствие Pseudomonas aeruginosa в единице препарата (г) – Отсутствие Staphylococcus aureus в единице препарата (г) – Для колисодержащих препаратов – отсутствие в единице препарата (г) БОЕ бактериофага (для препаратов с содержанием E.coli не менее 1010 КОЕ допускается не более 10 БОЕ бактериофага) |
Раздел этой ОФС «Определение микробиологической чистоты иммунобиологических лекарственных средств, содержащих живые микроорганизмы» построен следующим образом: «Питательные среды, используемые в испытаниях», «Отбор и подготовка испытуемых образцов», таблицы с указанием условий проведения испытаний, «Методика», «Учет результатов».
ОФС.1.7.2.0012.15 «Производственные пробиотические штаммы и штаммы для контроля пробиотиков» вводится впервые и распространяется на штаммы микроорганизмов, используемые в производстве пробиотиков для медицинского применения [157]. В ОФС указано, что для производства ЛП должны использоваться пробиотические производственные штаммы микроорганизмов с терапевтическим действием, подтвержденным клинически, депонированные в Национальной или Международной коллекции. Кроме того, в ОФС изложены требования к отбору, проверке и хранению рекомендуемых штаммов микроорганизмов, а также к биологическим свойствам тест-штаммов микроорганизмов, рекомендуемых для контроля антагонистической активности производственных штаммов и лекарственных препаратов пробиотиков.
ОФС.1.8.1.0002.15 «Иммунобиологические лекарственные средства» вводится впервые и содержит требования, предъявляемые к производству, исходному сырью, штаммам, показателям качества, упаковке, маркировке, условиям транспортирования и хранения иммунобиологических препаратов, включая препараты пробиотиков [7].
Заключение
Разработка фармакопейных требований к оценке качества препаратов пробиотиков обеспечивает комплексный подход к вопросам их стандартизации, основанных на национальных требованиях, сформированных с учетом системы обеспечения качества лекарственных средств в РФ. Материалы выполненных исследований включены в десять ОФС («Пробиотики», «Бифидосодержащие пробиотики», «Лактосодержащие пробиотики», «Колисодержащие пробиотики», «Споровые пробиотики», «Иммунобиологические лекарственные средства», «Безопасность пробиотиков для медицинского применения», «Микробиологическая чистота», «Специфическая активность пробиотиков для медицинского применения» и «Производственные штаммы и штаммы для контроля»), вошедших в ГФ РФ XIII издания.
Библиографическая ссылка
Осипова И.Г., Евлашкина В.Ф., Давыдов Д.С., Саканян Е.И. ОБЩИЕ ФАРМАКОПЕЙНЫЕ СТАТЬИ НА ПРЕПАРАТЫ ПРОБИОТИКИ ДЛЯ ГОСУДАРСТВЕННОЙ ФАРМАКОПЕИ РФ XIII ИЗДАНИЯ – ПЕРВЫЙ ОПЫТ В МИРОВОЙ ФАРМАКОПЕЙНОЙ ПРАКТИКЕ // Международный журнал прикладных и фундаментальных исследований. 2016. № 6-2. С. 272-276;URL: https://applied-research.ru/ru/article/view?id=9595 (дата обращения: 03.03.2026).
DOI: https://doi.org/10.17513/mjpfi.9595

