Камеди – вещества, выделяемые растениями, и представляющие собой высокомолекулярные углеводы, полимеры глюкозы, арабинозы, галактозы, рамнозы и уроновых кислот. Камедетечение является защитным механизмом растений в ответ на старение, стресс или повреждение, при этом в области раны сосуды ксилемы закрываются камедью, предохраняя растение от потери воды и инвазии патогенов.
Являясь гидрофильными соединениями, камеди растворяются в воде с образованием очень вязких растворов. В силу этого и ряда других свойств камеди широко применяют в различных отраслях промышленности, а также в качестве вакцинных адъювантов и компонентов систем доставки лекарственных препаратов [1, 2, 7].
Композиция конкретной камеди сильно варьирует по соотношению моносахаров полисахаридных компонентов не только от вида растения, но и от сезона года, в котором произошло камедетечение [6]. Полисахаридные компоненты исследованной в данной работе камеди вишни (Prunus cerasus/Cerasus vulgaris) в основном представлены соединениями группы арабиногалактанов [6]. Арабиногалактан представляет собой полимер галактозы и арабинозы, обладающий биологической активностью, в том числе иммуномодулирующей активностью [4, 8]. Данная активность арабиногалактана предположительно обусловлена структурой его молекулы, сходной по строению с полисахаридом бактериальной клеточной стенки. Согласно данным ряда исследований арабиногалактан обладает антибактериальной активностью [5, 9].
Вышесказанное позволяет предположить, что за счет своего состава и свойств камеди способны оказывать влияние на развитие раневого процесса.
Цель данного исследования – оценка особенностей заживления инфицированной раны после ее обработки камедью вишни в первой фазе раневого процесса.
Материалы и методы исследования
Исследуемую нами камедь «Ceravul» (камедь Вишни обыкновенной, Cerasus vulagris/Prunus cerasus) заготавливали в экологически чистых зонах – Государственное природоохранное учреждение Национальный парк «Браславские озера» Республики Беларусь.
Полученную камедь измельчали на бытовой мельнице (предварительно обработанной АХД 2000) и просеивали через стерильное металлическое сито (ГОСТ 3924-47).
Измельченную камедь выдерживали под УФ-лучами в течение 15 мин (ламинарный шкаф MSC9, Jouan, Thermo Electron Corporation, США). Для оценки стерильности 50 мг обработанной УФ камеди инкубировали в 2 мл триптон-соевого бульона в течение суток.
Влияние камеди на репаративные процессы in vivo изучали на 20 беспородных белых мышах-самцах массой 18-20 г (питомник «Рапполово» РАМН), разделенных на две одинаковые группы (опыт и контроль). В экспериментальные группы были отобраны животные без признаков отклонений внешнего вида, так, чтобы индивидуальное значение массы не отклонялось от среднего значения в группе более чем на ± 10 %. Животные находились в идентичных условиях кормления и содержания. Мышей содержали в клетках по 5 особей в условиях искусственного освещения (по 12 часов темного и светлого времени), принудительной 12-кратной в час вентиляции, при температуре 18-26 °C и относительной влажности 30-70 %.
Содержание и использование лабораторных животных соответствовало правилам, принятым Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных целей, а также Приказу МЗ РФ № 708Н от 23 августа 2010 г. Все манипуляции над животными проводили в условиях чистой операционной вивария ФГБУ «РНИИТО им. Р.Р. Вредена» Минздрава России с соблюдением правил асептики и антисептики под внутривенным наркозом. Все процедуры с животными были рассмотрены и утверждены Локальным этическим комитетом по использованию животных на предмет соответствия этическим принципам.
Условия содержания животных соответствовали стандартам, указанным в руководстве «The Guide for Care and Use of Laboratory Animals» (ILAR publication, National Academy Press, 1996) [10].
Влияние камеди на процесс ранозаживления изучали на модели свежей контаминированной раны. Оперативное вмешательство проводили под кетаминовым наркозом (0,1 мл 5 % раствора). Животное фиксировали в специальном станке в положении на животе. Предварительно проводили эпиляцию места вмешательства и обработку операционного поля раствором АХД. Осуществляли разрез по паравертебральной линии длиной 3 см., на всю толщу кожи. Производили обработку ран: в опытной группе – порошком камеди, в контрольной – раствором фурацилина. Далее рану вели открыто. Эвтаназию животных производили путём передозировки тиопентала натрия – 100 мг внутрибрюшинно.
Морфологические исследования проводили на 5, 7 и 10 сутки. Для их проведения выделяли макропрепарат, содержащий область раны и блок окружающих его тканей. Материал фиксировали 10 % нейтральным формалином в течение 24 часов. Мягкие ткани в дальнейшем обезвоживали в водных растворах этанола восходящей концентрации с использованием станции проводки гистологического материала Microm SТР-120 (США) с последующей заливкой в парафин на заливочной станции Leica (Германия). Срезы, толщиной 5 мкм, получали на санном микротоме Leica (Германия). Окраску гематоксилином и эозином («Биовитрум», Россия) выполняли с использованием станции окраски «Рафаэлло» (Италия). Патоморфологический анализ гистологических препаратов и фотодокументацию проводили на микроскопе Nikon E-50i (Япония).
Результаты исследования и их обсуждение
В результате анализа макропрепаратов, соответствующих пятым суткам исследования, у мышей контрольной группы отмечалась слабая краевая эпителизация в области дефекта (рис. 1, Б). Дефект поверхностно выполнен гнойно-некротическими массами, на дне дефекта – молодая грануляционная ткань с густой лейкоцитарной инфильтрацией. В некротических массах и грануляцонной ткани было выявлено большое количество кокков, расположенных диффузно и скоплениями (рис. 1, А).
По сравнению с контролем у мышей опытной группы на пятые сутки краевая эпителизация области дефекта была более выражена, и наблюдалось частичное закрытие эпидермисом значительной части дефекта под струпом из слабоэозинофильных масс и тканевого детрита. Среди грануляций, заполняющих раневой дефект микробных тел не наблюдалось (рис. 1, В).
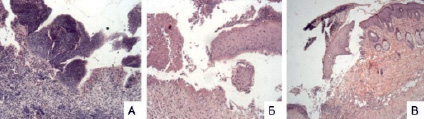
Рис. 1. Фотографии срезов микропрепаратов контроля (А и Б) и опыта (В) на 5 сутки (окраска гематоксилин и эозин, ув. А и Б х200, В х100). А (контроль) – дно дефекта, выполненное гнойно-некротическими инфицированными массами; Б (контроль) – неэпителизированный участок раневой поверхности (слева), краевая эпителизация слабо выражена; В (опыт) – более выраженная эпителизация раневой поверхности под струпом из слабоэозинофильных масс и тканевого детрита
На седьмые сутки у мышей контрольной группы наблюдалась эпителизация раневой поверхности на значительном протяжении и частичная отслойка струпа, представленного тканевым детритом со скоплениями лейкоцитов. Поверхность раневого дефекта на 4/5 была покрыта эпидермисом, подрастающим под струп. Отмечалось нарушение стратификации новообразованного эпидермиса в результате истончения шиповатого и зернистого слоев. Между пластом новообразованного эпидермиса и заполняющей дефект созревающей грануляционной тканью присутствовали скопления белковых масс и эритроцитов с единичными лимфоцитами и лейкоцитами среди них. Было отмечено уменьшение воспалительной инфильтрации грануляционной ткани, в толще грануляций были выявлены единичные безъядерные мышечные волокна (рис. 2, А, Б).
У мышей опытной группы на седьмые сутки также наблюдалась частичная отслойка струпа. Однако в отличие от контроля раневая поверхность была эпителизирована полностью, а под струпом, представленным тканевым детритом с примесью лейкоцитов, расположен пласт новообразованного эпидермиса, полностью покрывающий площадь раневого дефекта. Вертикальная зональность пласта новообразованного эпидермиса была нарушена в результате истончения шиповатого и зернистого слоев, также как и у контрольных животных. Под эпидермисом была расположена грануляционная ткань с очагами ослизнения, отека, капиллярного полнокровия и скоплениями фибрина. Субэпителиально отмечалась слабо выраженная воспалительная инфильтрация, а также слабая, но более выраженная, чем в контроле, лейкоцитарная инфильтрация созревающей грануляционной ткани (рис. 2, В, Г).
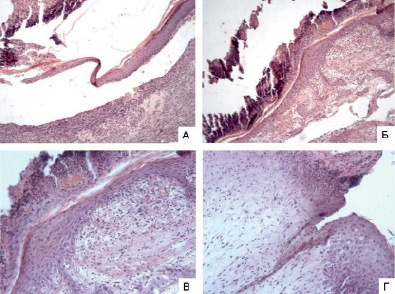
Рис. 2. Фотографии срезов микропрепаратов контроля (А и Б) и опыта (В и Г) на 7 сутки (окраска та же, ув. А – х100, Б – х200, В и Г – х400). А и Б – эпителизация раневой поверхности на большом протяжении, уменьшение воспалительной инфильтрации грануляционной ткани, частичная отслойка струпа; В и Г – эпителизация раневой поверхности на всем протяжении, субэпителиально слабо выраженная воспалительная инфильтрация, частичная отслойка струпа
На десятые сутки у мышей контрольной группы отмечалась субтотальная эпителизация: с обоих краев раневой дефект был покрыт эпидермисом. Наблюдалась частичная отслойка струпа, а в центре дефекта под струпом сохранялся очаг неэпителизированной поверхности мягких тканей, заполненный белковыми массами с врастающей в них грануляционной тканью разной степени зрелости. В дне дефекта была выявлена слабо выраженная лейкоцитарная инфильтрация детрита и молодых грануляций. Субэпителиально располагалась зрелая грануляционная ткань со слабо выраженной воспалительной инфильтрацией (рис. 3, А).
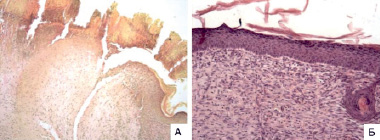
Рис. 3. Фотографии срезов микропрепаратов контроля (А) и опыта (Б) на 10 сутки (окраска А – по Ван Гизону, Б – гематоксилин и эозин, ув. А х100, Б х200. А (контроль) – субтотальная эпителизация раневой поверхности, в центре сохраняется гранулирующая рана под струпом (на рисунке слева), в зрелой грануляционной ткани слабо выраженная воспалительная инфильтрация субэпителиально, частичная отслойка струпа; Б (опыт) – эпителизация раневой поверхности на всем протяжении, субэпителиальный фиброз и слабо выраженная воспалительная инфильтрация в поверхностных слоях, полная отслойка струпа
В отличие от контроля для мышей опытной группы на десятые сутки была показана полная эпителизация раневой поверхности с восстановлением зональности эпидермиса, а также полная отслойка струпа. Отмечались субэпителиальный фиброз и слабо выраженная воспалительная инфильтрация в поверхностных слоях. Наблюдалось созревание грануляционно-фиброзной ткани, заполняющей дефект.
Представленные результаты свидетельствуют об отсутствии раздражающего действия вишневой камеди на окружающие ткани, что согласуется с данными других авторов по оценке влияния гуаровой камеди на мышечные ткани лабораторных животных [2]. Кроме того, согласно полученным данным применение вишневой камеди способствует более ранней элиминации микробных клеток из раны, вероятно, за счет иммуномодулирующих и антибактериальных свойств камеди, продемонстрированных ранее рядом авторов [4, 5, 8, 9].
Заключение
В целом, по результатам исследования можно заключить, что применение вишневой камеди в первой фазе раневого процесса приводит к ускорению процесса заживления, что, по-видимому, обусловлено биоактивными веществами, входящими в ее состав.
Библиографическая ссылка
Нетылько Г.И., Румакин В.П., Божкова С.А., Полякова Е.М. ОЦЕНКА ВЛИЯНИЯ КАМЕДИ «CERAVUL» НА ПРОЦЕСС РАНОЗАЖИВЛЕНИЯ В ЭКСПЕРИМЕНТЕ IN VIVO // Международный журнал прикладных и фундаментальных исследований. 2016. № 7-2. С. 226-229;URL: https://applied-research.ru/ru/article/view?id=9798 (дата обращения: 15.02.2026).

