Плотоядные и грызуны занимают прочно свою нишу в работе ветеринарной службы, причем с каждым годом увеличивается количество домашних животных и в том числе декоративных грызунов. Все большее количество ветеринарных специалистов вынуждены интересоваться заболеваниями экзотических животных, ставших частыми пациентами ветеринарных клиник. Важное санитарно-эпидемиологическое значение имеют нематодозы как плотоядных, так и лабораторных и декоративных грызунов [4, 6]. При совместном их содержании с другими животными возможна инвазия гельминтами, характерными для грызунов и этих животных и человека, в связи, с чем важным аспектом изучения являются антропозоонозы [1-3;5, 7,8].
Цель исследований
Изучить изменения морфологических параметров крови и некоторые особенности поведения грызунов и плотоядных зараженных нематодами.
Материалы и методы исследования
Материалом для исследований явились фекалии, кровь и сыворотка крови от лабораторных и декоративных грызунов (сем. Muridae, Zapodidae, Myocastoridae), а также от пушных зверей: енотовидной собаки, песцов и лисицы, принадлежащих зверохозяйствам Кировской области. Проводили как исследование фекалий, так и полное гельминтологическое вскрытие. Определяли количество эозинофилов. Выявление яиц гельминтов в фекалиях плотоядных (песцов, серебристо-черных и рыжих лисиц, енотовидных собак, норок) проводили методом флотации по Фюллеборну. Учет эффективности дегельминтизации осуществляли методом копроовоскопии фекалий до и через 10 дней после дачи антигельминтика, с использованием счетной камеры ВИГИС (Котельников Г.А., Мигачева Л.Д., 1987). Дегельминтизацию в случае обнаружения яиц проводили тетрамизолом групповым способом. При этом обнаружили различные виды нематод (сифаций, аспикулюрисов). У хищных пушных зверей обнаружили токсокароз и токсаскариоз. Также были изучены некоторые морфофункциональные особенности и ряд показателей у зараженных гельминтами и практически здоровых крыс, на экспериментальных моделях (принудительного плавания и поведения в открытом поле). Исследования крови проводили стандартными гематологическими методами с использованием программного обеспечения для анализа в медицине и биологии Vision Bio (Epi) west medical produktions-und Handels GmbH (Austria). Эксперименты на животных проводились с соблюдением биоэтических норм и правил в соответствии с Хельсинской декларацией.
Результаты исследования и их обсуждение
При исследовании грызунов наибольшее количество видов гельминтов мы обнаружили у лабораторных крыс, наименьшее у диких и декоративных. Однако в пробах фекалий от клеточных пушных зверей этот показатель возрастал до 95,5 % и через несколько дней после плановой дегельминтизации он снижался, у дегельминтизированного поголовья до 92,2 %. Яйца токсокар находили в фекалиях большинства видов животных зверохозяйства (песцы, серебристо-черные и рыжие лисицы, енотовидные собаки) (таблица).
Эффективность дегельминтизации клеточных пушных зверей при токсокарозе «критический тест»
|
вид животного |
количество яиц гельминтов в 1 г фекалий, |
||
|
до дачи препарата |
через 30 дней после дегельминтизации |
снижение числа яйц в гр. фекалий. % |
|
|
песец (n = 5) |
176,5 + 20,2 |
28,5 + 24,2 |
83,86 |
|
лисица (n = 5) |
163,2 + 31,2 |
26,5 + 20,6 |
83,77 |
|
енотовидная собака (n = 5) |
126,5 + 20,2 |
27,1 + 10,2 |
78,58 |
Однако количество яиц в гр. фекалий после дегельминтизации снизилось, как и некоторые гематологические показатели (абсолютное количество эозинофиллов) однако экстенсивность инвазии оставалась высокой (таблица) (рисунок, А, Б).
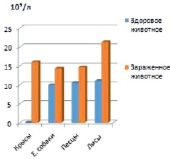
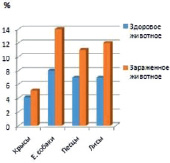
А Б
Результаты исследования периферической крови лейкоцит. А – абсолютное количество лейкоцитов %. Б – абсолютное количество эозинофиллов, %
С целью выяснения степени влияния инвазий на гематологические показатели экспериментальных животных провели исследования периферической крови здоровых и спонтанно инвазированных гельминтами крыс, Е. собак, песцов и лис. При лабораторном исследовании крови гельминтозах у крыс до дегельминтизации было выявлено повышение эозинофилов от 5,0 ± 0,6 до 17,73 ± 2,72 в зависимости от сезона года. Количество эритроцитов уменьшилось от 6,94 ± 0,17 до 4,97 ± 0,22, количество гемоглобина уменьшилось от 125,3 ± 2,00 до 80,0 ± 27,9 и лейкоцитов 16,0 ± 1,2 до 21,3 ± 2,0 увеличилось. При исследовании сыворотки крови у песцов выявляли от 10 % до 15 % эозинофилов, у лисиц – от 13 % до 17 %, у енотовидной собаки – от 11 % до 13 % (рисунок). У всех опытных животных после дегельминтизации наблюдали снижение до 7-11 % у песцов, до 7-10 %, у енотовидной собаки, до 7-14 % у лисиц (рисунок).
По результатам проведенных на светомикроскопическом уровне и на фиксированных препаратах, наших исследований, установлено, что у крыс, Е. собак, лисиц и песцов, клеточные структуры периферической крови варьируют. Таким образом, исследование крови крыс в динамике показали, что под влиянием паразитарных антигенов существенно изменяется морфологический состав крови. Все эти показатели находятся в прямой зависимости от интенсивности инвазии.
С целью изучения влияния гельминтов на поведение животных нами были исследованы особенности «поведения крыс в открытом поле». Тест заключается в количественном измерении компонентов поведения животного в новом открытом пространстве. Крыс помещали в центр «Открытого поля» и засекали время выхода из центрального квадрата. Как известно, в «Открытом поле» у крыс проявляется, защитно-оборонительная реакция. Эмоциональный статус животного оценивали по числу болюсов. Подсчитывали число пересеченных квадратов как показатель горизонтальной двигательной активности, число вертикальных стоек – показатель вертикальной двигательной активности, число дефекаций и уринаций, рассчитывали сумму дефекаций и уринаций. Определяли время реакции замирания, время реакции обнюхивания и время грумминга. Проверку результатов на нормальное распределение. Так как значения времени грумминга, числа дефекаций и уринаций не подчинялись закону нормального распределения, сравнение их средних проводили с помощью критерия знаков. В итоге изменений в поведении у спонтанно зараженных грызунов не зафиксировали. При исследовании физиологии поведения крыс методом принудительного плавания, проводили рандомизацию животных по устойчивости к физической нагрузке. Каждое животное по одному самцу помещали в цилиндр с водой, диаметром 18 см, высотой 40 см, т.е. достаточного размера для того, чтобы крысы в нем могли свободно плавать. Температура воды поддерживается в пределах + 29- + 30 °С. Плавание осуществляли с грузом.
В ходе эксперимента изучалось поведение крыс и выяснилось, что каждое животное совершало движения в различных направлениях, сочетания этих движений разнообразны: были серии пробежек вдоль стенки ОП и только потом – различные повороты и наоборот. Наибольшие различия в группах здоровых и инвазированных крыс отмечены в группе экспериментального моделирования. Крысы, у которых был зарегистрированы гельминтозы, показали меньшую продолжительность плавания (здоровые крысы плавают с 10 % грузом от массы тела более 12 минут, крысы умеренно инвазированные гельминтами плавали 7,5 ± 3 минуты). Отмечали увеличение ЧДД и пульса после принудительного плаванья: у здоровых крыс пульс выше на 5 % и на 8 % дыхание, у заражённых крыс после принудительного плавания пульс возрастал на 7,5 %, а дыхание 11,5 %, что свидетельствует о напряжении систем, обеспечивающих гомеостаз. В связи с тем, что адаптационные резервы снижены у животных, инвазированных гельминтами, происходят изменения функций ряда органов и систем и это приводит к искажению результатов экспериментальных исследований в области биологии и медицины, а нередко делает невозможным проведение эксперимента. Учитывая вышесказанное, необходимо комплексное исследование животных, которых планируется использовать в экспериментах и надлежащих размножению. При выявлении гельминтозов проводить своевременную дегельминтизацию и карантинирование. Только в этом случаи возможно адекватной оценки эксперимента и предотвращения заражения человека гельминтами.
Заключение
Таким образом, необходимо больше внимания уделять гельминтозам грызунов, их распространению, лечению и профилактике. Организационно-хозяйственные мероприятия, направленные на предупреждение заболеваний грызунов гельминтозами, заключаются в обеспечении соответствующих условий кормления и содержания. Необходимо проводить обучение работников вивариев, магазинов и биостанций. Информировать владельцев животных о болезнях домашних питомцев, а студентов и школьников о технике безопасности при занятиях с лабораторными животными. Рекомендовали проводить своевременную обработку инвентаря дезрастворами (5 % растворами хлорной извести или лизола, достаточно эффективен 0,3 % раствор азида натрия); обеспечить чистоту вивариев, ограничить использование деревянных клеток, навоз обезвреживать биотермический с добавлением 0,3 % раствора азида натрия [1-3], уничтожающего яйца гельминтов, но в отличие от других дезинфектантов не вызывающего почвенной катастрофы, и проводить своевременную дезинсекцию. При вводе в виварий или подворье нового поголовья рекомендовали проводить 30 дневное карантинирование с 2 кратным гельминтоовоскопическим исследованием по методам Фюллеборна и Калантарян. Соблюдать принцип – все-пусто; все-занято. Проводить полное гельминтологическое вскрытие всех павших животных. Перед вывозом животных из вивария для проведения исследований на кафедрах необходимо подвергать их паразитологическим обследованиям [6, 8].
Библиографическая ссылка
Мутошвили Л.Р., Жданова О.Б., Часовских О.Б., Окулова И.И., Березина Ю.А., Бельтюкова З.Н., Кокорина А.Е. ИЗМЕНЕНИЯ МОРФОЛОГИЧЕСКИХ ПАРАМЕТРОВ КРОВИ И НЕКОТОРЫЕ ОСОБЕННОСТИ ПОВЕДЕНИЯ ГРЫЗУНОВ И ПЛОТОЯДНЫХ, ЗАРАЖЕННЫХ НЕМАТОДАМИ // Международный журнал прикладных и фундаментальных исследований. 2016. № 10-1. С. 70-73;URL: https://applied-research.ru/ru/article/view?id=10290 (дата обращения: 11.02.2026).

