Проблема лечения последствий тяжелой черепно-мозговой травмы (ЧМТ), инсульта и ряда других нейродегенеративных процессов является наиболее сложной и социально значимой проблемой современной медицины. Более половины пациентов с тяжелой ЧМТ страдают от функциональных нарушений и когнитивных дефицитов. Первичные механизмы ЧМТ, такие как непосредственное механическое повреждение, кровоизлияние и повреждение аксонов, сопровождающиеся гибелью нейронов и глии, повреждением кровеносных сосудов и диффузной аксональной дегенерацией, приводят к возникновению сложных вторичных нарушений, включая активацию микроглии, провоспалительных цитокинов и хемокинов, нарушение гомеостаза кальция, дисфункции митохондрий и повышению уровня окислительного стресса. Показано, что активация иммунного ответа достигает максимума между 5 и 7 днями после ЧМТ и остается повышенной в течение 2 недель, что дает временной интервал для терапевтического вмешательства [1]. Наконец, ЧМТ приводит к апоптозу и ишемии ткани головного мозга и функциональному дефициту [2].
Несмотря на многочисленные исследования механизмов вторичного повреждения, фармакологические методы лечения, направленные на устранение вторичных факторов, не показали благоприятных результатов [3].
В настоящее время одним из наиболее перспективных методов терапии ЧМТ является нейротрансплантация 3D носителей из синтетических биодеградируемых биосовместимых материалов, которые бы создавали определенное микроокружение при длительном процессе восстановления нейронных сетей и поддерживали дефект до восстановления структуры ткани [4, 5]. Но оптимальное время лечения для максимизации функционального восстановления, избегая потенциально антагонистического острого, провоспалительного микроокружения, остается недостаточно изученным.
В связи с вышеизложенным на модели открытой черепно-мозговой травмы мышей линии C57BL/6 была проведена сравнительная оценка функционального состояния животных при имплантации 3D биодеградируемого скаффолда на 5 и 7 сутки посттравматического периода.
Материалы и методы исследования
Работа выполнена на 8–10 недельных мышах самцах линии C57BL/6 массой 20–22 г (n = 40). Основные правила содержания и ухода за экспериментальными животными соответствовали нормативам, данным в руководстве «Guide for care and use of laboratory animals (ILAR publication, 1996, National Academy Press)», Национальном стандарте РФ ГОСТ 33044-2014 «Принципы надлежащей лабораторной практики (GLP)» и были согласованы с этическим комитетом при ФГБОУ ВО НижГМА Минздрава России.
3D биодеградируемый скаффолд был создан с использованием микростереолитографической техники путем комбинации высокомолекулярного модифицированного хитозана (80 кДа, степень ацетилирования 0.15) (Поли[(1 → 4)-2-амино-2-деокси-β-D-глюкоза]) [6] и высокомолекулярной гиалуроновой кислоты [7], соотношение по массе 3:1.
Моделирование открытой черепно-мозговой травмы (ЧМТ) проводилось «weight-drop» способом по оригинальной методике [5, 8]. Механическую травму наносили путем падения груза с тупой поверхностью, что обеспечивает ускорение головы при минимальном локальном воздействии в точке приложения травмирующей силы. Данная модель наиболее полно воспроизводит клиническую картину тяжелого очагового повреждения головного мозга и позволяет изучать травматические изменения, сопровождающиеся вторичной гибелью нервных клеток, а также оценивать грубые двигательные нарушения, изменения тонкой координации движений, дефицит когнитивных функций [5].
В ходе эксперимента животные случайным образом были разделены на группы: первая группа – контрольные животные (PBS, 30 µl; имплантация на 7 сутки) (n = 10), вторая – контрольные животные (PBS, 30 µl, имплантация на 5 сутки) (n = 10), третья группа – имплантация скаффолда (размер 2х1 мм) на 7 сутки (n = 10), четвертая – имплантация скаффолда (размер 2х1 мм) на 5 сутки (n = 10).
Функциональными параметрами оценки трансплантации 3D биодеградируемого скаффолда являлись тестирование неврологических, когнитивных функций мышей, а также определение иммунологического статуса животных до моделирования травмы и затем через 1, 3, 4, 5 и 6 месяцев после ЧМТ.
Тест «открытое поле»
Животное помещалось в центр поля (установка Open Field LE800S, PanLab / Harvard Apparatus Испания; Stoelting, США), и за ним велось наблюдение. Видеорегистрация отдельных поведенческих реакций животных осуществлялась с помощью видеокамеры SONY SSC-G118 (Япония). Регистрация и анализ данных контролировались программой Smart v.3.0.03. (Panlab Harvard Apparatus Испания; Stoelting, США).
С целью определения нарушений ориентировочно-исследовательской и двигательной активности животных в течение 5 минут регистрировались следующие показатели поведенческой активности: горизонтальная двигательная активность ГДА: пройденное расстояние (см), длительность двигательной активности (с); скорость двигательной активности (см/с); вертикальная двигательная активность ВДА (количество стоек – подъемов на задние лапы).
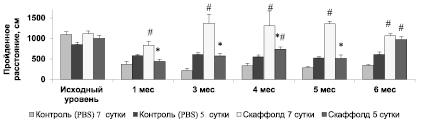
Рис. 1. Динамика изменения горизонтальной двигательной активности мышей линии C57BL/6 в посттравматическом периоде. Примечание. * – p < 0,05 по отношению к группе с имплантированием скаффолда на 7 сутки; критерий Манна – Уитни; # – p < 0,05 по отношению к контрольной (PBS) группе животных; критерий Манна – Уитни. n = 10 в каждой группе
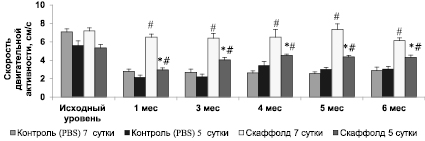
Рис. 2. Динамика изменения скорости двигательной активности мышей линии C57BL/6 в посттравматическом периоде. Примечание. * – p < 0,05 по отношению к группе с имплантированием скаффолда на 7 сутки; критерий Манна – Уитни; # – p < 0,05 по отношению к контрольной (PBS) группе животных; критерий Манна – Уитни. n = 10 в каждой группе
Тест распознавания нового объекта
Тест состоял из трех этапов: привыкание, обучение и тестирование [9]. В ходе эксперимента на этапах обучения и тестирования регистрировали совокупное время исследования знакомого и нового объектов (установка LE802S PanLab / Harvard Apparatus Испания; Stoelting). Видеорегистрация отдельных поведенческих актов поведения животных осуществлялась с помощью видеокамеры SONY SSC-G118 (Япония). Регистрация и анализ данных контролировались программой Smart v.3.0.03. (Panlab Harvard Apparatus Испания; Stoelting, США). Состояние функций памяти определяли как дискриминационное время исследования нового объекта (DIR) по формуле
Dir = [(доля времени исследования животным нового объекта – доля времени исследования знакомого объекта во время сеанса тестирования) / общее время исследования во время сеанса тестирования] х 100 [10].
Метод проточной цитофлуометрии
Иммунологический статус животных оценивали методом проточной цитометрии с помощью набора BD™ CBA Human Th1/Th2 Cytokine Kit (кат. номер 550749) для количественного определения в растворе цитокинов IL-2, IL-4, IL-6, IL- 10, TNF в одном образце на приборе BD FACSCanto II. Регистрация и анализ данных контролировались программой FCAP ArrayTM.
Результаты исследования и их обсуждение
Тест «открытое поле»
Предварительное тестирование животных не выявило различий между группами по основным поведенческим показателям.
ЧМТ приводила к нарушению структуры поведения животных, происходило снижение двигательной и исследовательской активности в сравнении с исходным уровнем (p < 0,05). Восстановления ориентировочно-исследовательского поведения не происходило ни в одной из групп мышей с ЧМТ.
Начиная с 1 месяца посттравматического периода горизонтальная двигательная активность в группе с имплантированием в очаг повреждения 3D биодеградируемого скаффолда на 7 сутки после травмы восстанавливалась и была достоверно выше, чем в контрольной группе (p < 0,05) и группе с имплантированием скаффолда на 5 сутки (p < 0,05) (рис. 1).
К 6 месяцу посттравматического периода в группе с имплантированием 3D скаффолда на 5 сутки двигательная активность также восстанавливалась до исходного уровня. Расстояние, пройденное животными за время тестирования, статистически значимо превышало показатель контрольной группы (p < 0,05) и не отличалось от аналогичного показателя группы с имплантированием скаффолда на 7 сутки (p > 0,05).
Результаты исследования показали, что скорость общей двигательной активности в обеих группах с имплантированием скаффолда в очаг повреждения (на 5 и 7 сутки после травмы) восстанавливалась к 1 месяцу посттравматического периода и была достоверно выше, чем в соответствующих контрольных группах животных (p < 0,05).
В то же время в группе с трансплантацией скаффолда на 7 сутки скорость двигательной активности была статистически значимо выше в сравнении с группой с имплантированием скаффолда на 5 сутки на протяжении всего посттравматического периода (p < 0,05) (рис. 2).
Тест распознавания нового объекта
Результаты исследования показали, что моделирование открытой тяжелой ЧМТ у животных приводит к значительным нарушениям гиппокампзависимой кратковременной памяти, что согласуется с данными литературы [5].
К 1 месяцу посттравматического периода дискриминационное соотношение времени исследования в группе с трансплантацией скаффолда на 7 сутки достоверно превышало соответствующий показатель группы с имплантированием скаффолда на 5 сутки (p < 0,05) (рис. 3). Начиная с 3 месяца дискриминационное соотношение времени исследования между опытными группами статистически значимо не различалось (p > 0,05) и было достоверно больше, чем в соответствующих контрольных группах мышей с введением в очаг повреждения раствора PBS (p < 0,05), что свидетельствует о восстановлении функций СА1-СА3 полей непространственной гиппокампзависимой кратковременной памяти распознавания.
Иммунофлюоресцентный анализ
Результаты исследования показали, что имплантирование 3D скаффолда через 1 неделю после ЧМТ снижало выраженность воспалительного процесса, так как уровень провоспалительных (TNF, IL-2, IL-6) и противовоспалительных (IL-4, IL-10) цитокинов в плазме крови мышей был достоверно ниже, чем в контрольной группе (p < 0,05) и группе с имплантированием скаффолда через 5 дней после нанесения травмы (p < 0,05) (рис. 4).
Важно отметить, что трансплантация 3D биодеградируемого скаффолда через 7 дней после ЧМТ не стимулировала аутоиммунные процессы в головном мозге животных. Концентрация цитокина IL-17A в плазме крови была статистически значимо меньше, чем в группе с имплантацией скаффолда на 5 сутки после ЧМТ (p < 0,05).
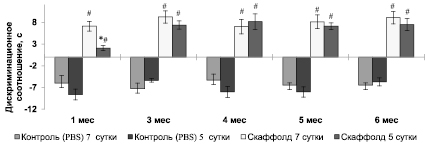
Рис. 3. Исследование функций кратковременной памяти мышей линии С57BL/6 в посттравматическом периоде. Примечание. * – p < 0,05 по отношению к группе с имплантированием скаффолда на 7 сутки; критерий Манна – Уитни; # – p < 0,05 по отношению к контрольной (PBS) группе животных; критерий Манна – Уитни. n = 10 в каждой группе
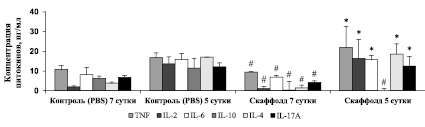
Рис. 4. Влияние времени имплантации 3D скаффолда на уровень цитокинов плазмы крови мышей в посттравматическом периоде. Примечание. * – p < 0,05 по отношению к группе с имплантированием скаффолда на 7 сутки; критерий Манна – Уитни; # – p < 0,05 по отношению к контрольной (PBS) группе животных; критерий Манна – Уитни. n = 10 в каждой группе
Заключение
Выявленные функциональные параметры жизнедеятельности мышей свидетельствовали о более выраженном нейропротекторном действии имплантации через 1 неделю после ЧМТ 3D биодеградируемого скаффолда на восстановление поведенческих и когнитивных функций животных, а также иммунного статуса, в сравнении с имплантацией скаффолда на 5 сутки после травмы.
Одним из важнейших показателей, характеризующих выраженность воспалительной реакции после перенесенной травмы, является цитокиновый спектр плазмы крови. Цитокины вырабатываются не только клетками иммунной системы, но и вспомогательными клетками, обладающими иммунной функцией, такими как астроциты и клетки микроглии, играющими важную роль в восстановлении структуры головного мозга после травмы.
Трансплантация 3D биодеградируемого скаффолда через 7 суток после травмы мозга, в отличие от трансплантации на 5 сутки, оказывала положительное действие на восстановление структуры поведения животных в отдаленном посттравматическом периоде.
Также в работе было установлено: имплантирование через 1 неделю после моделирования ЧМТ в очаг повреждения 3D биодеградируемого скаффолда, в сравнении с трансплантацией на 5 сутки, оказывало более быстрое протекторное действие на восстановление когнитивных функций мышей в посттравматическом периоде.
Кроме того, имплантирование через неделю после ЧМТ в очаг повреждения 3D биодеградируемого скаффолда, в отличие от трансплантации скаффолда на 5 сутки посттравматического периода, снижало выраженность воспалительного процесса и не стимулировало аутоиммунные процессы в головном мозге при черепно-мозговой травме по уровню цитокинов крови в посттравматическом периоде.
Таким образом, имплантирование 3D скаффолда на 7 сутки после ЧМТ является наиболее оптимальным временем для дальнейшего функционального восстановления животных.
Библиографическая ссылка
Балябин А.В., Тихобразова О.П., Щелчкова Н.А., Андреева Н.Н., Тимашев П.С., Баграташвили В.Н., Мухина И.В. ВЛИЯНИЕ ВРЕМЕНИ ИМПЛАНТАЦИИ 3D БИОДЕГРАДИРУЕМОГО СКАФФОЛДА НА ФУНКЦИОНАЛЬНОЕ ВОССТАНОВЛЕНИЕ МЫШЕЙ ЛИНИИ C57BL/6 ПРИ ТЕРАПИИ ТЯЖЕЛОЙ ОТКРЫТОЙ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЫ // Международный журнал прикладных и фундаментальных исследований. 2017. № 12-1. С. 98-102;URL: https://applied-research.ru/ru/article/view?id=11971 (дата обращения: 11.02.2026).
DOI: https://doi.org/10.17513/mjpfi.11971

