Хронический стресс многими исследователями рассматривается в качестве одной из причин, способствующих развитию таких широко распространённых в мире патологий, как метаболический синдром, диабет 2-го типа, воспалительное заболевание кишечника [1, 2]. В связи с этим большой теоретический и практический интерес представляют исследования, которые направлены на выявление метаболических нарушений, вызванных хроническим стрессом.
В последние годы эффекты хронического стресса в отношении пищеварительной системы, обеспечивающей начальные этапы метаболизма пищевых веществ, широко изучались как на клиническом уровне, так и в модельных опытах на животных. Показано, что для хронического стресса характерно образование язв в желудке и двенадцатиперстной кишке [3], раннее появление признаков воспаления в кишечнике [2] и изменение ряда его функциональных параметров (моторика, кровоток, пассивная проницаемость эпителия) [2]. Вместе с тем до сих пор остаётся недостаточно изученным вопрос о возможном действии хронического стресса на мембранное пищеварение, обеспечивающее заключительные стадии гидролиза пищевых веществ, а также на систему всасывания глюкозы.
Цель настоящей работы состояла в том, чтобы в опытах на крысах, как экспериментальной модели, оценить влияние хронического умеренного стресса, вызванного ежедневной 3-часовой иммобилизацией животных на протяжении 3–16 дней, на активность ряда мембранных пищеварительных ферментов (глюкоамилаза, щелочная фосфатаза, аминопептидаза N) и на всасывание глюкозы в тонкой кишке.
Материалы и методы исследования
Эксперименты проводились на 48 взрослых крысах (Вистар, самцы, масса тела 180 – 220 г) в полном соответствии с Директивой Европейского Совета (The European Council Directive (86/609/EEC)) по соблюдению этических принципов в работе с лабораторными животными и одобрены Комиссией по контролю за содержанием и использованием лабораторных животных при ФГБУН Институт физиологии им. И.П. Павлова РАН.
Перед опытами и в ходе их проведения (за исключением периодов с 3-часовой иммобилизацией крыс опытных групп) животные содержались в нормальных условиях в отношении температуры и освещения, а также имели свободный доступ к стандартному лабораторному корму и воде.
Уровень всасывания глюкозы в тонкой кишке оценивался с использованием разработанной нами ранее методики [4], основанной на существовании высокой степени корреляции между скоростью свободного потребления животными, предварительно голодавшими 18–20 ч, концентрированных растворов глюкозы и способностью тонкой кишки к ее всасыванию.
В предварительных опытах в течение 5–6 ч у всех крыс регистрировалась временнaя динамика свободного потребления ими раствора глюкозы (200 г/л). Для этого каждое животное после предварительного голодания в течение 18–20 ч помещали в индивидуальную клетку размером 14х21х11 см с двумя мерными поилками, в одной из которых содержался раствор глюкозы в концентрации 200 г/л, а в другой – обычная вода. Однако следует отметить, что на протяжении всего опыта крысы пили только раствор глюкозы. По данным проведенных измерений методом линейной регрессии с использованием программного ресурса «ORIGIN 7» (OriginLabCorporation, USA) для каждого из животных определялось среднее значение объемной скорости (мкл/мин) потребления этого раствора во временном интервале от 60 до 300–360 мин, когда, как показали наши предшествующие исследования [4], эта скорость относительно постоянна. На основе результатов, полученных в нескольких предварительных опытах, было сформировано шесть групп крыс (три – опыт и три – контроль) с близкими средними значениями скоростей потребления раствора.
Животных из опытных групп ежедневно подвергали трёхчасовой иммобилизации в отдельных специальных клетках, частично ограничивающих их подвижность, а у контрольных – на 3 часа отбирали корм. Этот вид стрессорного воздействия является моделью умеренного психологического и физического стресса [1]. Опыты с иммобилизацией проводили в дневное время с 10:00 до 13:00.
Уровень всасывания глюкозы в тонкой кишке у всех животных (опытных и контрольных) оценивали через 3, 10 и 16 дней от начала опытов со стрессом в интервале 10:00 и 15:00 ч (в период неактивной фазы питания у крыс). В эти же сроки (по окончании опыта с регистрацией потребления глюкозы) у части опытных и контрольных животных после их декапитации отбирались пробы слизистой оболочки из различных отделов тонкой кишки для определения в них активности пищеварительных ферментов: глюкоамилазы (НФ 3.2.1.3), щелочной фосфатазы (НФ 3.1.3.1) и аминопептидазы N (НФ 3.4.11.2) с использованием общепринятых биохимических методов [5]. При этом для каждого фермента рассчитывались значения как удельной (мкмоль/мин на г ткани), так и интегральной активности с учётом массы слизистой оболочки (мкмоль/мин на участок тонкой кишки или мкмоль/мин на всю кишку). Поскольку при разных вариантах расчётов наблюдались близкие закономерности в изменении ферментативных активностей, в статье приведены лишь данные в отношении интегральной активности (мкмоль/мин на всю кишку).
Кроме того, у некоторых животных из опытных и контрольных групп (n = 6) в 1-й, 4-й, 10-й и 16-й дни опытов через 30 мин после начала стрессорного воздействия из хвостовой вены отбирались пробы крови для определения в них концентрации кортикостерона. Определение проводилось путем иммуноферментного анализа с использованием набора реагентов «Кортикостерон крыса/мышь-ИФА» фирмы ХЕМА в соответствии с инструкцией, приложенной к набору.
Статистическая обработка результатов проводилась с использованием t-критерия Стъюдента. За достоверные принимались различия при P < 0,05.
Результаты исследования и их обсуждение
В ходе опытов у крыс, подвергавшихся ежедневной иммобилизации, в первые три дня отмечалось небольшое, статистически недостоверное, снижение прироста массы тела по сравнению с контролем (лишение корма без стресса). Однако в дальнейшем прирост массы тела был близким у крыс опытных и контрольных групп. Снижение массы тела у взрослых или набора массы тела у растущих животных под влиянием иммобилизационного стресса наблюдали также другие исследователи [6–8]. В частности, было установлено, что такое снижение массы тела при хроническом иммобилизационном стрессе обусловлено проявлением анорексии [7, 8].
В первый день опытов иммобилизация животных вызывала значительное, статистически достоверное (P < 0,003) повышение уровня кортикостерона в плазме крови по сравнению с контролем (35,06 ± 3,79 мкг/дл против 17,52 ± 2,32 мкг/дл). Однако в дальнейшем наблюдалось существенное снижение этого показателя. Так, на 4-й день уровень кортикостерона в опытной группе крыс составлял 21,39 ± 2,06 мкг/дл, а в контрольной – 8,47 ± 2,06. На 10-й день он был 12,75 ± 1,64 и 10,5 ± 1,52 мкг/дл в опыте и контроле соответственно, а на 16-й день – 10,55 ± 1,63 и 7,1 ± 1,30 мкг/дл в опыте и контроле соответственно. Снижение уровня кортикостерона в крови при хронической иммобилизации крыс наблюдали также другие исследователи [7–9]. Этот феномен свидетельствует о проявлении у животных привыкания к многократно повторяющемуся стрессору. Такой ответ глюкокортикоидов считается адаптивным, поскольку он направлен на снижение действия хронического стресса на энергетический баланс [7–9].
В настоящей работе уровень всасывания глюкозы в тонкой кишке оценивался, как указано выше, по скорости свободного потребления животными концентрированного раствора глюкозы. Эта методика позволила впервые исследовать процесс в условиях, максимально близких к естественным.
Через 3 дня стрессорного воздействия у крыс опытной группы наблюдалось хотя и небольшое, но статистически достоверное (P < 0,05) повышение по сравнению с контролем всасывания глюкозы в тонкой кишке (рис. 1). Однако в дальнейшем (через 10 и 16 дней) этот показатель возвращался к контрольным значениям. Если принять во внимание полученные нами данные в отношении изменения уровня кортикостерона в крови на аналогичных сроках, то можно предположить, что именно этот фактор является наиболее существенным в развитии адаптации системы всасывания глюкозы в тонкой кишке к хроническому умеренному стрессу. Такое предположение подкрепляется также другими нашими данными, полученными в предшествующей работе [10], которые свидетельствуют о том, что стимулирующие эффекты кортикостерона в отношении всасывания глюкозы в тонкой кишке зависят от дозы вводимого гормона.
Наши результаты сложно сравнивать с данными других авторов, которые в своих исследованиях использовали другие модели хронического стресса и другие подходы к определению всасывательной способности тонкой кишки к глюкозе. Тем не менее в отношении характера ответа системы всасывания глюкозы (повышение всасывания) они согласуются с данными, полученными ранее [6], которые демонстрируют повышение экспрессии одного из основных транспортёров глюкозы (SGLT1) в энтероцитах тонкой кишки в ответ на стресс, вызванный ограничением подвижности животных в течение 4 ч ежедневно, в течение 5 дней в неделю на протяжении 8 недель. Кроме того, в литературе имеются данные об увеличении всасывания глюкозы в тонкой кишке в условиях in vitro и повышении экспрессии двух основных транспортёров глюкозы (SGLT1 и GLUT2) в энтероцитах в ответ на хронический психологический стресс [11].
В настоящем исследовании определялись активности трёх кишечных мембранных ферментов, различающихся по функциональной специализации:
1) глюкоамилазы – ключевой карбогидразы, которая участвует в гидролизе α-декстринов, образующихся после расщепления крахмала панкреатической α-амилазой;
2) щелочной фосфатазы, которая выполняет, помимо участия в гидролизе эфиров фосфорной кислоты и в регуляции всасывания липидов [12], также важные защитные функции (участвует в детоксикации бактериального липополисахарида, в снижении воспаления, вызванного этим токсином, а также в ограничении бактериальной транслокации, через эпителий кишечника [13];
3) аминопептидазы N, расщепляющей олигопептиды, и вовлеченной также в транспорт холестерина через кишечный эпителий [14] и в иммунные ответы [15].
Как можно видеть на рис. 2, через три дня стрессорного воздействия активность глюкоамилазы в слизистой оболочке тонкой кишки у крыс опытной группы была повышена на 69 % по сравнению с контролем (P < 0,05), но на более длительных сроках (через 10 и 16 дней) не отличалась от контрольных значений.
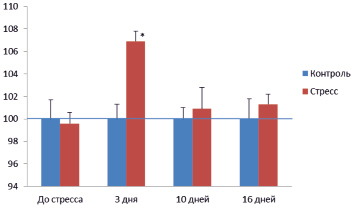
Рис. 1. Скорость свободного потребления концентрированного (200 г/л) раствора глюкозы у контрольных (Контроль) и опытных (Стресс) крыс. По вертикали: скорость потребления глюкозы в % к соответствующему контролю; по горизонтали: время от начала опытов (дни). *P < 0,05 по отношению к контролю
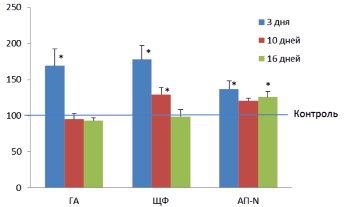
Рис. 2. Активности глюкоамилазы (ГА), щелочной фосфатазы (ЩФ) и аминопептидазы N (АП-N) в различные дни стрессорного воздействия и в контроле. По вертикали: ферментативная активность в % к контролю, принятому за 100; *P < 0,05 по отношению к контролю
Поскольку развитие адаптации этой ферментативной активности к хроническому умеренному стрессу происходило примерно так же, как и при всасывании глюкозы, можно предположить, что и в данном случае наиболее существенным фактором в уменьшении реакции со стороны активности фермента являлось снижение концентрации кортикостерона в крови.
Несколько иные особенности развития адаптации наблюдались в отношении двух других ферментов: щелочной фосфатазы и аминопептидазы N (рис. 2). Активность щелочной фосфатазы в тонкой кишке у крыс опытной группы повышалась на 78 % по сравнению с контролем (P < 0,05) через 3 дня, несколько снижалась через 10 дней (оставаясь выше, чем в контроле) и не отличалась от контроля в конце экспериментального периода (через 16 дней). В то же время активность аминопептидазы N в тонкой кишке у крыс опытной группы, будучи повышенной через 3 дня (на 37 % по сравнению с контролем, P < 0,05), лишь незначительно снижалась к концу экспериментального периода.
Учитывая то, что эти ферменты, помимо участия в пищеварении, выполняют также важные защитные функции, можно думать, что активация данных функций может влиять на скорость адаптации указанных ферментов к хроническому умеренному стрессу. Принимая во внимание это обстоятельство, можно также предположить, что длительное поддержание на повышенном уровне активности аминопептидазы N в слизистой оболочке тонкой кишки может быть одним из факторов, вносящих вклад в формирование таких неблагоприятных для организма последствий, как повышение уровня холестерина в крови и развитие воспалительного процесса в кишечнике, обусловленного повышенным проникновением через кишечный эпителий некоторых вирусов и патогенных бактерий [15].
В современной литературе можно найти лишь ограниченное число работ, касающихся исследования реакции мембранных пищеварительных ферментов в тонкой кишке на хронический умеренный стресс. В частности, как сообщается в недавней работе [11], авторы не обнаружили изменений активности мальтазы и сахаразы, но наблюдали повышение активности лактазы в слизистой оболочке тонкой кишки в ответ на хронический психологический стресс. Полученные в настоящей работе результаты частично восполняют пробел в данной области исследований, показывая особенности адаптации к хроническому умеренному стрессу таких мембранных пищеварительных ферментов, как глюкоамилаза, щелочная фосфатаза и аминопептидаза N.
Заключение
Таким образом, в ходе нашего исследования показано, что адаптация к хроническому умеренному стрессу, вызванному иммобилизацией животных, по-разному проявляется в отношении различных функциональных показателей тонкой кишки. Способность тонкой кишки к всасыванию глюкозы и активность глюкоамилазы (ключевой фермент при гидролизе углеводов) изменяются лишь в начальный период (через 3 дня) хронического умеренного стресса, а в дальнейшем не отличаются от контроля, тогда как адаптация щелочной фосфатазы и аминопептидазы N (ферменты, которые выполняют, помимо участия в гидролизе жиров и белков, важные защитные функции) к вышеуказанному стресс-фактору происходит в течение более длительного времени.
Библиографическая ссылка
Громова Л.В., Дмитриева Ю.В., Алексеева А.С., Полозов А.С., Груздков А.А. ВЛИЯНИЕ ХРОНИЧЕСКОГО УМЕРЕННОГО СТРЕССА НА СОСТОЯНИЕ КИШЕЧНОЙ ПИЩЕВАРИТЕЛЬНОЙ СИСТЕМЫ У КРЫС // Международный журнал прикладных и фундаментальных исследований. 2017. № 11-2. С. 228-232;URL: https://applied-research.ru/ru/article/view?id=12004 (дата обращения: 03.03.2026).

