Язвенный колит (ЯК) – хроническое рецидивирующее заболевание, характеризующееся диффузными воспалительными поражениями слизистой оболочки толстой кишки с развитием местных и системных осложнений [1]. Деструктивные изменения слизистой оболочки толстой кишки при ЯК обусловливают накопление на клеточных мембранах пула токсических соединений с высокой окислительной активностью [2]. Состояние мембраны эритроцита можно рассматривать в качестве доступной модели для установления общих мембранных характеристик [3] . Доказано, что под влиянием продуктов катаболического пула при ЯК активируются процессы перекисного окисления, приводя к дезорганизации белкового и фосфолипидного слоев мембраны [4]. На поверхности мембран увеличивается количество окисленных продуктов, в основном за счет гидроперекисей жирных кислот. Значительно увеличивается сорбционная способность эритроцита – показатель, отражающий целостность примембранного слоя [2].
В последнее время при лечении различных заболеваний в комплексной терапии используются антиоксиданты. Одним из представителей этой группы препаратов является отечественный препарат «Мексидол». Препарат усиливает активность мембраносвязанных ферментов и активно ингибирует свободнорадикальное окисление липидов биомембран [5]. Однако более детального анализа молекулярных механизмов действия данного препарата на клеточные мембраны в настоящее время не существует.
Показано, что мексидол способен оказывать влияние на некоторые липидные компоненты мембраны эритроцитов при ЯК [6]. Однако данных о количественном изменении содержания белков цитоплазматической мембраны клеток красной крови под воздействием мексидола мы не обнаружили, что и легло в основу нашего исследования.
Цель исследования: сравнить уровень содержания основных белковых компонентов мембраны эритроцитов у здоровых лиц и пациентов с ЯК, а также оценить влияние препарата «Мексидол» на состояние белков цитоплазматической мембраны красных клеток крови in vitro при ЯК.
Материалы и методы исследования
Исследование выполнено с соблюдением этических принципов медицинских исследований с участием человека, изложенных в Хельсинкской декларации Всемирной медицинской ассоциации. Получено одобрение Комитета по биомедицинской этике ФГБУ НЦРВХ (протокол № 9 от 9.11.2012). Обследован 51 пациент с ЯК в период острой атаки, мужчины и женщины. Средний возраст пациентов 38,7 ± 1,9 лет, средняя длительность заболевания 5,7 ± 0,9 лет. Группу сравнения составили 30 клинически здоровых лиц, сопоставимых по полу и возрасту. В обеих группах проводили забор периферической венозной крови из локтевой вены в пробирку с гепарином. Затем осаждали эритроцитарную массу, отмывая ее 3 раза от сыворотки. Для получения препаратов мембран эритроциты разрушали осмотическим шоком по методу Dodge [7].
Все операции по выделению и очистке водорастворимой фракции белков проводили в холодной комнате (–5 °С). Замороженные в жидком азоте мембраны гомогенизировали с добавлением фенилметилсульфонилфторида (PMSF) в 0.1 М Трис-HCl-буфере с 0.1 % додецилсульфатом натрия (SDS) (pH 7.6). Полученный экстракт центрифугировали при 15000g. Суммарный белок осаждали четырехкратным объемом ацетона и растворяли в 0.5 М Tрис-HCl-буфере (pH 6.8). Концентрацию общего белка определяли с использованием набора Qubit Protein Assay Kit (Invitrogen, США) на приборе Qubit согласно инструкции фирмы изготовителя.
Электрофорез проводили по методу Лэммли [8] в полиакриламидном геле (ПААГ) с концентрацией разделяющего геля 7.5 и 15 % в присутствии SDS с использованием аппаратуры и реактивов фирмы Bio-Rad. На дорожки наносили по 10 мкг суммарного белка. Гели окрашивали раствором Кумасси R-250 (Sigma, США). Для определения вида белка на электрофореграмме набор маркеров фирмы Thermoscientific (#26614). В результате анализа 324 электрофореграмм (7,5 и 15 % ПААГ) оценивали уровень (у.е.) 10 мембранных белков эритроцитов, из них структурные белки – α-спектрин, β-спектрин, анкирин, актин и тропомиозин, функциональные белки – анион-транспортный белок (АТБ), белок полосы 4.1, транспортер глюкозы, глицеральдегид-3-фосфат-дегидрогеназа (Г-3-ФДГ) и глутатион-S-трансфераза. Содержание белков в каждой полосе определяли по уровню максимальной интенсивности окраски Кумасси R-250, с применением компьютерной программы [9].
Статистическую обработку проводили с помощью пакета программ «Statistica 10.0». Данные в сравниваемых группах анализировали с помощью непараметрического U-критерия Манна–Уитни (для независимых переменных) и критерия Вилкоксона (для зависимых переменных). Различия считали статистически значимыми при р < 0,05. Характер различий групповых переменных исследовали с использованием дискриминантного анализа и корреляционного анализа по Спирману.
Результаты исследования и их обсуждения
При сравнительном анализе 10 структурных белков цитоплазматической мембраны у больных ЯК было обнаружено их достоверное снижение, в сравнении с группой клинически здоровых лиц (табл. 1(1–3)).
Для того чтобы понять, какие из изучаемых нами белков наиболее существенно дискриминировали группы здоровых лиц и пациентов с ЯК, мы провели дискриминантный анализ между этими группами. В результате было выявлено, что в разделение группы здоровых лиц и пациентов с ЯК наибольший вклад вносили следующие белки: актин, тропомиозин, транспортер глюкозы и глутатион–S–трансфераза. Установлено, что они на 93 % дискриминировали исследуемые группы (рис. 1). Причем наиболее существенный вклад в эту дискриминацию вносили белки актин (ƛ = 0,632) и тропомиозин (ƛ = 0,708). При этом уравнение канонических значений выглядело следующим образом.
Поскольку нас интересовало, какое влияние оказывает мексидол на содержание белковых компонентов в мембране красных клеток крови, мы сравнивали изучаемые параметры не только в группах здоровых и больных ЯК, но также и в подгруппах с инкубацией эритроцитов в физиологическом растворе (NaCl) и растворе мексидола. Было обнаружено, что мексидол не оказывал существенного влияния на содержание белков в мембране эритроцитов у клинически здоровых людей (табл. 1 (3–4)). При воздействии мексидола на эритроциты у больных ЯК уровень изучаемых белков цитоплазматической мембраны оставался ниже, чем в группе здоровых людей (табл. 1 (2–4)). Однако в сравнении с инкубацией в растворе NaCl у этой группы пациентов, было установлено достоверное увеличение в мембране содержания трех белков: актин, Г-3-ФДГ и тропомиозин (табл. 1 (1–2)).
Таблица 1
Содержание белковых компонентов (у.е) мембраны эритроцитов у больных язвенным колитом и здоровых лиц. Me (Q25:Q75)
|
Больные ЯК |
Здоровые |
|||
|
1 |
2 |
3 |
4 |
|
|
Переменные |
физ. р-р |
мексидол |
физ. р-р |
мексидол |
|
а-спектрин |
0,433 (0,334–0,661) |
0,538 (0,321–0,673) |
0,99 (0,78–1,35) |
1,042 (0,919–1,346) |
|
b-спектрин |
0,497 (0,297–0,720) |
0,539 (0,305–0,763) |
1,02 (0,7–1,326) |
0,965 (0,875–1,242) |
|
анкирин |
0,091 (0,054–0,147) |
0,086 (0,058–0,151) |
0,199 (0,151–0,288) |
0,188 (0,126–0,261) |
|
АТБ |
0,316 (0,185–0,405) |
0,315 (0,195–0,422) |
0,725 (0,586–0,884) |
0,769 (0,598–0,907) |
|
полоса 4.1 |
0,284 (0,190–0,351) |
0,259 (0,186–0,359) |
0,521 (0,418–0,711) |
0,557 (0,368–0,68) |
|
тр. глюкозы |
0,252 (0,168–0,311) |
0,27 (0,183–0,317) |
0,414 (0,327–0,563) |
0,424 (0,346–0,527) |
|
актин |
0,262* (0,202–0,358) |
0,289* (0,21–0,36) |
0,757 (0,674–0,893) |
0,715 (0,641–0,833) |
|
Г-3-ФДГ |
0,155* (0,127–0,217) |
0,184* (0,131–0,251) |
0,387 (0,311–0,427) |
0,39 (0,3–0,454) |
|
тропомиозин |
0,491* (0,280–0,890) |
0,58* (0,312–1,014) |
0,723 (0,581–0,946) |
0,754 (0,622–0,977) |
|
гл.-S-тр-за |
0,229 (0,154–0,377) |
0,263 (0,181–0,389) |
0,766 (0,466–0,921) |
0,702 (0,544–0,845) |
Примечание. Для всех переменных Р1,3 и Р2,4 < 0,05 (критерий Манн – Уитни); * Р1,2 < 0,05 (критерий Вилкоксона).
К = 1,536 + 5,827·тр.глюкозы – 7,489·актин + 1,607·тропомиозин – 2,505·гл.–S–тр-за
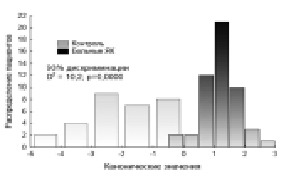
Рис. 1. Диаграмма распределения здоровых лиц и больных ЯК с инкубацией эритроцитов в физиологическом растворе по данным дискриминантной функции белков мембраны эритроцитов и канонического анализа
Учитывая тот факт, что эритроцит не имеет внутриклеточных образований, способных синтезировать белки, вероятно, увеличение уровня данных белков при инкубации красных клеток крови в растворе мексидола происходит за счет снижения уровня других, не изученных нами, белковых компонентов цитоплазматической мембраны.
Как известно, фермент Г-3-ФДГ принимает участие в выработке энергии, которая в свою очередь необходима для функционирования структурных белков, таких как актин и тропомиозин. Таким образом, увеличение количества этих трех белков после инкубации красных клеток крови пациентов с ЯК в растворе мексидола можно рассматривать как положительное действие данного лекарственного средства на мембрану эритроцита в условиях исследуемой патологии.
Далее мы выявили, что в разделение групп здоровых лиц и пациентов с ЯК с инкубацией эритроцитов в растворе мексидола наибольший вклад вносили три белка: анионтранспортный белкок, транспортер глюкозы и также глутатион–S–трансфераза. Они дискриминировали данные группы на 90 % (рис. 2). Наибольший вклад в разделение этих групп вносил АТБ (ƛ = 0,58). Уравнение канонических значений для дискриминации групп с инкубацией эритроцитов в мексидоле выглядело следующим образом (рис. 2).
Для лучшего понимания взаимодействия структурных и функциональных белков мембраны эритоцитов при ЯК и воздействии мексидола на этот процесс, мы провели корреляционный анализ по Спирману. В группе контроля (здоровые люди) была выявлена корреляционная связь следующих белков: транспортер глюкозы, АТБ и Г-3-ФДГ со всеми изучаемыми структурными белками, за исключением тропомиозина (табл. 2). Наиболее тесная корреляция наблюдалась между актином и транспортером глюкозы (R = 0,82), а также между актином и Г-3-ФДГ (R = 0,89). Кроме этого в данной группе была выявлена корреляция Гл.-S-трансферазы с актином (R = 0,46) и тропомиозином (R = 0,65). После инкубации эритроцитов здоровых лиц в растворе мексидола выявленные корреляционные связи сохранялись, за исключением взаимодействия Г-3-ФДГ с а-спектрином и Гл.-S-трансферазой с актином (табл. 2). Следует отметить, что воздействие мексидола приводило к более тесной корреляции между актином и АТБ, транспортером глюкозы и анкирином, но снижало взаимодействие между Г-3-ФДГ и актином.
Анализ взаимосвязи функциональных и структурных белков в группе больных ЯК с инкубацией клеток в растворе NaCl показал корреляции изучаемых функциональных белков только с двумя структурными белками: актин и тропомиозин (табл. 3). После инкубациеи эритроцитов в растворе мексидола в группе пациентов с ЯК сохранялись те же корреляционные связи белков, что и при инкубации в физиологическом растворе (табл. 3). Воздействие мексидола в этой группе усиливало связи между актином и АТБ, транспортером глюкозы и актином, но существенно снижало взаимодействие Г-3-ФДГ с актином и тропомиозином.
К = 2,047 – 9,849·АТБ + 12,249·тр.глюкозы – 3,436· гл.–S–тр-за
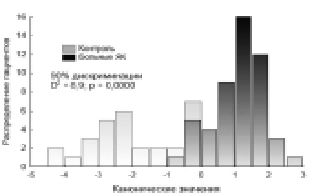
Рис. 2. Диаграмма распределения здоровых лиц и больных ЯК с инкубяцией эритроцитов в растворе мексидола по данным дискриминантной функции белков мембраны эритроцитов и канонического анализа
Таблица 2
Характер корреляционных связей между структурными и интегральными белковыми компонентами цитоплазматической мембраны у клинически здоровых лиц
|
АТБ |
Тр. глюкозы |
Г-3-ФДГ |
Гл.-S-тр-за |
|||||
|
NaCl |
Мексидол |
NaCl |
Мексидол |
NaCl |
Мексидол |
NaCl |
Мексидол |
|
|
a-спектрин |
0,52 |
0,47 |
0,77 |
0,6 |
0,41 |
– |
– |
– |
|
b-спектрин |
0,53 |
0,59 |
0,76 |
0,71 |
0,42 |
0,43 |
– |
– |
|
Анкирин |
0,65 |
0,57 |
0,53 |
0,75 |
0,42 |
0,58 |
– |
– |
|
Актин |
0,59 |
0,75 |
0,82 |
0,86 |
0,89 |
0,79 |
0,46 |
– |
|
Тропомиозин |
– |
– |
– |
– |
– |
– |
0,65 |
0,62 |
Таблица 3
Характер корреляционных связей между структурными и интегральными белковыми компонентами цитоплазматической мембраны у пациентов с язвенным колитом
|
АТБ |
Тр. глюкозы |
Г-3-ФДГ |
Гл.-S-тр-за |
|||||
|
NaCl |
Мексидол |
NaCl |
Мексидол |
NaCl |
Мексидол |
NaCl |
Мексидол |
|
|
Актин |
0,68 |
0,81 |
0,82 |
0,95 |
0,86 |
0,74 |
0,73 |
0,74 |
|
Тропомиозин |
0,46 |
0,49 |
0,73 |
0,7 |
0,8 |
0,65 |
0,81 |
0,8 |
Заключение
Совокупность полученных в настоящем исследовании данных позволяет утверждать о достаточно серьезных изменениях белкового состава цитоплазматической мембраны эритроцитов при ЯК. Ранее проведенные исследования объясняют механизм повреждения мембран клеток при данной патологии [2]. Нами было обнаружено значительное снижение уровня исследуемых белковых компонентов в мембране красных клеток крови при ЯК в сравнении со здоровыми людьми. Кроме этого было показано, что мексидол может приводить к перераспределению белковых компонентов цитоплазматической мембраны эритроцита при ЯК, а также может оказывать влияние на взаимодействие структурных и интегральных белков мембраны.
Инкубация изолированных красных клеток крови в растворе мексидола не оказывает существенного влияния на уровень белков в цитоплазматической мембране здоровых лиц. В тех же условиях установлено достоверное увеличение уровня трех белков (актин, Г-3-ФДГ и тропомиозин) в группе больных ЯК.
Корреляционный анализ взаимодействия структурных и функциональных белков мембраны эритроцитов в группе здоровых людей выявил связь транспортера глюкозы, АТБ и Г-3-ФДГ со всеми структурными белками, кроме тропомиозина. После инкубации эритроцитов в растворе мексидола выявленные корреляционные связи сохранялись, за исключением взаимодействия Г-3-ФДГ с а-спектрином и Гл.-S-трансферазой с актином. Воздействие мексидола в этой группе приводило к более тесной корреляции между актином и АТБ, транспортером глюкозы и анкирином, но снижало взаимодействие между Г-3-ФДГ и актином. Подобный анализ для группы больных ЯК выявил связь всех изучаемых функциональных белков только с двумя структурными белками: актин и тропомиозин. После инкубации эритроцитов в растворе мексидола данные связи сохранялись. Воздействие мексидола в этой группе усиливало связи между актином и АТБ, транспортером глюкозы и актином, но существенно снижало взаимодействие Г-3-ФДГ с актином и тропомиозином.
Исследование содержания основных белковых компонентов мембраны эритроцитов у здоровых лиц и пациентов с ЯК, а также оценка влияния препарата «Мексидол» на состояние белков цитоплазматической мембраны красных клеток крови in vitro при язвенном колите проводятся впервые, в литературе подобных данных нет. Выявленные результаты не позволяют объяснить механизмы установленных закономерностей. Таким образом, полученные данные способствуют дальнейшему изучению механизмов действия мексидола на белковые компоненты мембраны красных клеток крови при язвенном колите.
Библиографическая ссылка
Сергеева А.С., Янькова Т.С., Сай О.В. СРАВНИТЕЛЬНЫЙ АНАЛИЗ СОДЕРЖАНИЯ БЕЛКОВЫХ КОМПОНЕНТОВ ЦИТОПЛАЗМАТИЧЕСКОЙ МЕМБРАНЫ ЭРИТРОЦИТОВ У ЗДОРОВЫХ ЛИЦ И ПАЦИЕНТОВ С ЯЗВЕННЫМ КОЛИТОМ // Международный журнал прикладных и фундаментальных исследований. 2019. № 10-1. С. 115-120;URL: https://applied-research.ru/ru/article/view?id=12877 (дата обращения: 10.03.2026).
DOI: https://doi.org/10.17513/mjpfi.12877

