Всестороннее изучение дикорастущей флоры вызвано наличием ряда существенных проблем как в области сохранения биоразнообразия видов, так и в области фитохимических, фармакологических и биотехнологических исследований [1, 2]. Большое внимание уделяется изучению роли копеечников [3–5], в том числе и в традиционной медицине [6] Монголии, Китая, решаются проблемы таксономии [7] и биохимии рода [8–10]. За последние десятилетия при помощи различных методов хроматографии из растений рода Hedysarum стали известны 155 соединений, которые показали предполагаемую активность: антиоксидантную, активность против старения, регулирование активности иммунной системы, противоопухолевую активность [11].
Значительный интерес с этой точки зрения представляет род Hedysarum флоры Кыргызстана – один из многочисленных родов, включает 34 вида [12], что составляет 17 % мирового видового разнообразия, среди которых высок процент эндемиков. Особенности климатических и экологических условий в Республике, разнообразие географических зон способствуют биосинтезу и накоплению в растениях физиологически активных соединений. Их видовой состав, ареал, биоморфологические характеристики впервые были представлены в монографии Султановой [13].
При поддержке Королевского ботанического сада, Кью нами созданы при Институте биотехнологии НАН КР семенной банк [14, 15], коллекции культуры тканей и изолированных органов растений дикорастущей флоры, где хранятся коллекции рода Hedysarum (www.plant-biotech.kg).
Целью данного исследования было провести скрининг на содержание флавоноидов и АОА в нативных растениях и культурах in vitro – hairy roots.
Материалы и методы исследования
Было исследовано 17 видов растений рода Hedysarum из коллекции семенного банка, половина видов имеет статус эндемиков. Два вида – H. chaitocarpum и H. montanum – были продублированы в сравнительном изучении и взяты из двух разных географических зон. Местонахождение и природоохранный статус испытуемых растений приведены в табл. 1. Использовались гербарный материал, а также культуры тканей in vitro – hairy roots для определения количественного содержания флавоноидов для каждого вида и распределения их по частям растения, а также расчета АОА.
Таблица 1
Содержание флавоноидов и АОА растений рода Hedysarum
|
Вид |
Природоохранный статус* |
Местонахождение |
Часть растения |
Сумма флавоноидов, % |
АОА, мг кверцетина/г сухого в-ва |
|
|
1 |
Hedysarum chaitocarpum Regel et Schmalh |
E,KRB,VU |
Чаткальский хребет, Сары-Челекский заповедник, ущелье реки Ходжа-Ата |
листья |
1,60 ± 0,03 |
29,09 ± 0,8 |
|
стебли |
0,36 ± 0,02 |
7,15 ± 0,2 |
||||
|
корни |
0,05 ± 0,0 |
9,34 ± 0,3 |
||||
|
Ферганский хребет, ущелье р. Кугарт |
листья |
3,62 ± 0,04 |
31,08 ± 0,5 |
|||
|
цветки |
2,52 ± 0,07 |
|||||
|
стебли |
0,21 ± 0,02 |
7,06 ± 0,03 |
||||
|
корни |
0,11 ± 0,01 |
9,29 ± 0,3 |
||||
|
2 |
Hedysarum cumuschtanicum B. Sultanova |
E,VU |
Талаский хребет, ущелье реки Кумуштаг |
листья |
2,52 ± 0,07 |
29,77 ± 0,4 |
|
цветки |
1,12 ± 0,01 |
21,06 ± 0,5 |
||||
|
3 |
Hedysarum daraut-kurganicum B. Sultanova |
E,VU |
Хребет Кавак-Тоо, окрестности села Мин-Куш |
листья |
1,74 ± 0,05 |
26,32 ± 0,01 |
|
цветки |
0,91 ± 0,02 |
14,39 ± 0,6 |
||||
|
стебли |
1,07 ± 0,06 |
18,41 ± 0,8 |
||||
|
корни |
0,09 ± 0,01 |
7,82 ± 0,3 |
||||
|
4 |
Hedysarum denticulatum Regel |
SE |
Алайский хребет, ущелье р. Оксу |
листья |
3,72 ± 0,04 |
38,76 ± 0,5 |
|
стебли |
0,79 ± 0,01 |
13,49 ± 0,04 |
||||
|
корни |
0,53 ± 0,01 |
26,31 ± 1,5 |
||||
|
5 |
Hedysarum dmitrievae Bajt |
SE |
Пскемский хребет, ущелье реки Кара-Корум |
листья |
3,22 ± 0,08 |
38,03 ± 0,7 |
|
цветки |
2,50 ± 0,03 |
33,79 ± 0,7 |
||||
|
стебли |
1,99 ± 0,02 |
19,25 ± 1,1 |
||||
|
корни |
0,24 ± 0,02 |
11,31 ± 0,1 |
||||
|
6 |
Hedysarum enaffae B. Sultanova |
E,VU |
Южный макросклон хребта Кунгей Ала-Тоо, бас. р. Тору – Айгыр |
листья |
1,63 ± 0.02 |
37,18 ± 1.9 |
|
цветки |
0,96 ± 0,02 |
25,00 ± 1.3 |
||||
|
Окончание табл. 1 |
||||||
|
Вид |
Природоохранный статус* |
Местонахождение |
Часть растения |
Сумма флавоноидов, % |
АОА, мг кверцетина/г сухого в-ва |
|
|
7 |
Hedysarum ferganensis Korsh. |
SE |
Между хребтом Ак-Шийрак и Ферганским хребтом, перевал Ой-Кайын |
листья |
2,33 ± 0,06 |
29,08 ± 0,5 |
|
цветки |
1,38 ± 0,02 |
21,72 ± 0,6 |
||||
|
стебли |
1,04 ± 0,02 |
13,52 ± 0,3 |
||||
|
корни |
0,11 ± 0,01 |
7,94 ± 0,1 |
||||
|
8 |
Hedysarum flavescensRegel. et Schmalh |
SE |
Ферганский хребет, перевал Урумбаш |
листья |
5,86 ± 0,03 |
40,45 ± 0,3 |
|
цветки |
8,19 ± 0,09 |
48,32 ± 0,9 |
||||
|
стебли |
1,64 ± 0,04 |
17,47 ± 0,5 |
||||
|
9 |
Hedysarum gypsaceum Korotk |
SE |
Чаткальский хребет, перевал Джеде-Бель |
листья |
0,97 ± 0,03 |
34,50 ± 1,9 |
|
стебли |
0,10 ± 0,01 |
7,84 ± 0,4 |
||||
|
корни |
0,11 ± 0,01 |
8,38 ± 0,03 |
||||
|
10 |
Hedysarum issykulensis E. Nikit. |
х.ц. |
Терскей Ала-Тоо, долина реки Конурулен, близ с. Конурулен |
листья |
1,68 ± 0,04 |
22,13 ± 1,0 |
|
стебли |
1,33 ± 0,04 |
23,87 ± 1,3 |
||||
|
корни |
0,69 ± 0,1 |
9,68 ± 0,2 |
||||
|
11 |
Hedysarum neglectum Ledeb. |
шр |
Ферганский хребет, между с. Кош- Дюбе и перевалом Шордобель |
листья |
8,04 ± 0,02 |
46,33 ± 1,6 |
|
цветки |
4,11 ± 0,08 |
31,51 ± 1,1 |
||||
|
стебли |
3,35 ± 0,1 |
20,69 ± 0,2 |
||||
|
12 |
Hedysarum kirghisorum B. Fedtsch. |
SE |
Долина реки Инылчек близ березовой рощи |
листья |
4,59 ± 0,07 |
40,67 ± 2,1 |
|
стебли |
1,27 ± 0,1 |
19,57 ± 0,9 |
||||
|
13 |
Hedysarum montanum B. Fedtsch. |
SE |
Хреб. Тахталык, близ с. Тахталык |
листья |
1,85 ± 0,05 |
27,38 ± 1,9 |
|
цветки |
1,42 ± 0,02 |
24,24 ± 0,9 |
||||
|
стебли |
0,56 ± 0,01 |
11,70 ± 0,5 |
||||
|
корни |
0,18 ± 0,04 |
9,36 ± 0,2 |
||||
|
Чуйсккая область, северный макросклон, хребет Кыргызского Ала-Тоо |
листья |
2,28 ± 0,03 |
29,19 ± 0,8 |
|||
|
стебли |
0,63 ± 0,01 |
|||||
|
14 |
Hedysarum songoricum B. Fedtsch. |
SE |
Хребет Кавак-Тоо, окрестности села Мин-Куш |
листья |
2,20 ± 0,01 |
34,08 ± 1,8 |
|
цветки |
1,46 ± 0,02 |
25,95 ± 1.4 |
||||
|
стебли |
1,06 ± 0,02 |
13,67 ± 0,3 |
||||
|
15 |
Hedysarum parvum B. Sultanova |
E,EN |
Пскемский хребет, ущелье реки Кара-Корум |
листья |
1,81 ± 0,1 |
28,52 ± 1,4 |
|
цветки |
0,85 ± 0,02 |
21,94 ± 0,4 |
||||
|
стебли |
0,23 ± 0,01 |
10,83 ± 0,4 |
||||
|
корни |
0,21 ± 0,02 |
16,78 ± 0,1 |
||||
|
16 |
Hedysarum santalaschi B. Fedtsch. |
E,VU |
Пскемский хребет, ущелье реки Кара-Корум |
листья |
2,18 ± 0,03 |
30,04 ± 0,6 |
|
цветки |
1,79 ± 0,01 |
31,47 ± 0,9 |
||||
|
стебли |
0,39 ± 0,02 |
9,29 ± 0,3 |
||||
|
корни |
– |
7,06 ± 0,03 |
||||
|
17 |
Hedysarum turkestanicum Regel et Schmalh |
E,VU |
Южные отроги Чаткальского хребта близ пос. Шекафтар |
листья |
1,40 ± 0,01 |
28,54 ± 0,3 |
Примечание. *E – эндемичный вид; SE – субэндемичный вид; VU – вид находится под риском стать вымирающим; EN – вымирающий вид; х.ц. – хозяйственно-ценный вид; шр – широко распространенный вид; KRB – вид, находящийся в Красной книге.
В образцах определяли сумму флавоноидов и антиоксидантную активность (АОА). Для расчета суммарного содержания флавоноидов использовали экспресс-методику [16, 17]. АОА определяли двумя методами – в соответствии с описанием патентного изобретения Т.В. Максимовой и иных [18] и с использованием DPPH (2,2-дифенил-1-пикрилгидразилом).
На хроматографе Agilent 1260 Infinity методом высокоэффективной жидкостной хроматографии (ВЭЖХ) определяли содержание изофлавона (формононетина) в экстрактах растений. Для анализа использовались нативные корни и hairy roots 4 видов растений рода Hedysarum из коллекции трансформированных корней копеечников, которые ранее были получены лабораторией Института биотехнологии растений НАН КР. Калибровку хроматографа проводили по стандарту формононетину с использованием колонки Eclipse Plus C18, 5 µm, 4,5 х 250 мм.
Результаты исследования и их обсуждение
Большее накопление флавоноидов отмечали в листьях по сравнению с другими частями растений, исключением был вид H. flavescens, у которого в цветках содержание флавоноидов превышало их содержание в листьях, данные представлены в табл. 1. Из 17 испытуемых видов наибольший эффект отмечен у H. neglectum, H. flavescens и H. kirghisorum. При сопоставлении одних и тех же видов, произрастающих в разных географических зонах (H. chaitocarpum и H. montanum), было отмечено, что количество флавоноидов существенно различалось. Это соответствует данным о том, что различия в химическом составе могут иметь место в пределах одного и того же вида в зависимости от географического происхождения [19].
Результаты определения АОА двумя методами представлены в табл. 1 и на рис. 1. Следует отметить, что наблюдалась определенная корреляция между данными, полученными в обоих экспериментах. Наивысшие показатели АОА были выявлены у H. flavescens, как в цветках, так и в листьях. Высокая АОА в цветках была отмечена у H. dmitrievae.
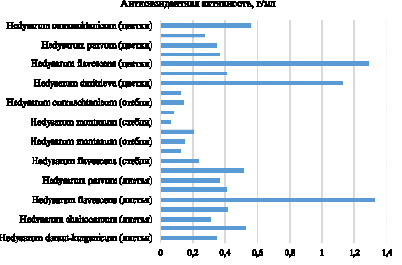
Рис. 1. Сравнительный анализ АОА в разных частях растений видов копеечника с использованием DPPH
Определенный интерес представляют изучение компонентов флавоноидной природы не только в нативных растениях, но и в тканях растений Hedysarum и проведение сравнительного анализа гербарного материала и культур тканей. В работе были использованы культуры hairy roots из коллекции банка семян Института биотехнологии [20].
Ранее нами совместно с И.Н. Кузовкиной (ИФР РАН) был проведен анализ корней эндемика H. enaffae (hairy root and isolated root) на базе Института фармакогнозии Университета им. Семмельвайса (Будапешт, Венгрия) [21]. Результаты ВЭЖХ анализа корней H. enaffae показали, что доминирующим компонентом культивируемых in vitro корней hairy roots являются изофлавоны – производные формононетина. Обнаруженные четко выраженные пики веществ соответствуют двум изофлавонам, которые были идентифицированы на основании данных ВЭЖХ и UV-спектроскопии и подтверждены данными 1H- и 13С ЯМР-спектрометрии, проведенной в Институте химической экологии им. Макса Планка в Йене (Германия). Результаты хроматографии показали, что доминирующим флавоноидом hairy roots and isolated roots копеечника является изофлавон ононин.
Изофлавон ононин является гликозидом агликона формононетина, который в свободном виде не обнаружен в корневых культурах H. enaffae (в отличие от hairy roots of H. theinum). Поскольку основным компонентом культивируемых корней H. enaffae является ононин, было определено количественное содержание этого изофлавона в hairy roots. На основании данных ВЭЖХ по площади пиков была вычислена концентрация ононина в этих двух культурах. Результаты показали, что концентрация ононина в hairy roots составляет 10,91 мг/г сухого веса корней (или 1,1 %), в то время как в изолированных корнях концентрация изофлавона – 0,945 мг/г сухого веса (или 0,095 %), т.е. на один порядок ниже.
Результаты приведены в табл. 2.
Таблица 2
Содержание формононетина в нативных (NR) и трансформированных корнях (HR) растений рода Hedysarum, мг/г сухого вещества
|
Вид |
Нативные корни |
Hairy roots |
|
H. daraut-kurganicum |
0 |
0,663 |
|
H. denticulatum |
0,271 |
1,212 |
|
H. parvum |
0,070 |
0,539 |
|
H. santalaschii |
0,056 |
1,247 |
Содержание формононетина в hairy roots превышало его содержание в нативных растениях более чем в 4 раза у H. denticulatum, более чем в 7 раз у H. parvum, более чем в 22 раза у H. santalaschii, а в нативных корнях H. daraut-kurganicum обнаруживаются следы формононетина.
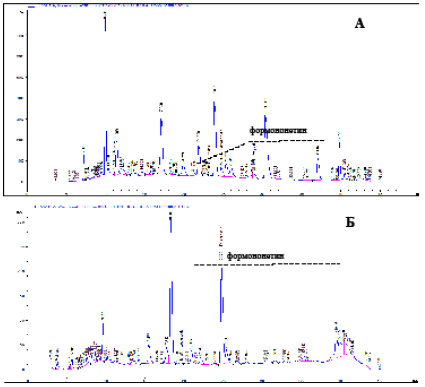
Рис. 2. Хроматограмма нативных (А) и hairy roots H. denticulatum (Б) по определению формононетина
Выводы
Исследованы 17 видов рода Hedysarum флоры Кыргызстана, большинство из которых имеют природоохранный статус «эндемики» и «субэндемики». В нативных растениях выявлено высокое содержание флавоноидов и АОА у H. neglectum, H. kirghisorum и H. flavescens. Сравнительное изучение содержания формононетина в нативных растениях и в hairy roots показало превышение его концентрации в несколько раз в hairy roots по сравнению с нативными растениями, что говорит о преимуществе использования методов биотехнологии.
Библиографическая ссылка
Умралина А.Р., Конурбаева Р.У. ФИТОХИМИЧЕСКИЕ И БИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ РАСТЕНИЙ КЫРГЫЗСТАНА РОДА HEDYSARUM // Международный журнал прикладных и фундаментальных исследований. 2021. № 10. С. 36-41;URL: https://applied-research.ru/ru/article/view?id=13289 (дата обращения: 11.02.2026).
DOI: https://doi.org/10.17513/mjpfi.13289

