Хроническая обструктивная болезнь легких (ХОБЛ) остается одним из наиболее распространенных хронических неинфекционных заболеваний и характеризуется значительной неоднородностью клинических проявлений. Традиционно выделяются бронхитический, эмфизематозный и смешанный фенотипы течения ХОБЛ [1, 2]. Рассматриваются особенности течения ХОБЛ у женщин, у лиц пожилого возраста, при ожирении, при сочетании бронхиальной астмы с ХОБЛ [2, 3]. В последние годы выделен особый фенотип ХОБЛ – ХОБЛ с частыми обострениями [4, 5]. В Испанских национальных рекомендациях по лечению ХОБЛ от 2012 г. выделяются четыре основных фенотипа: эмфизематозный и бронхитический с редкими обострениями; эмфизематозный с частыми обострениями; бронхитический с частыми обострениями; перекрест ХОБЛ и БА [6]. Важным критерием для выявления фенотипа с частыми обострениями, помимо регистрации более двух обострений в течение года, является то обстоятельство, что эти обострения развиваются через 4–6 недель от начала предыдущего обострения, если лечение не проводилось [7]. Как правило, обострения ХОБЛ развиваются при воздействии различных агентов и триггеров, но чаще всего является следствием контакта с инфекционными патогенами, что усиливает хроническое системное воспаление, которое лежит в основе патогенеза ХОБЛ [2, 8]. Системное воспаление при ХОБЛ сопровождается повышением уровня большинства про- и противовоспалительных цитокинов, прежде всего интерлейкинов (IL): IL-1 α , IL-1β, IL-6, IL-8, IL-18, IL-22 и фактора некроза опухоли – альфа (TNF-α), которые имеют тесную корреляцию с тяжестью заболевания и достигают максимальных значений в период обострения [9]. Нейтрофилы, Т-лимфоциты и макрофаги поддерживают воспаление в бронхах. Под действием триггерных факторов нейтрофилы мигрируют в легкие и являются источником свободных радикалов, а также выделяют нейтрoфильную эластазу, миелоперoксидазу, металлопрoтеазу, которые вместе с TNF-α и интерлейкинами являются основными медиаторами воспаления при развитии обструкции легких [10]. Ряд исследователей, изучая значение окислительного стресса в патогенезе ХОБЛ, определили в качестве эффекторов свободные радикалы и активные формы кислорода [11, 12]. Результатом окислительного стресса является непосредственное повреждающее действие на структуры легких, а также активация молекулярных механизмов, запускающих воспалительный процесс и продукцию провоспалительных цитокинов в легочной ткани. В связи с этим считается, что нарушение баланса между оксидантами и антиоксидантами играет значимую роль в патогенезе хронической обструктивной болезни легких [12]. Определить единственную причину формирования хронического воспалительного процесса достаточно сложно, но одной из наиболее частых причин нарушения энергетического баланса является гипоксия. Она характеризуется нарушением клеточного дыхания, недостаточностью биологического окисления и дефицитом энергии в клетках, что может служить важным патогенетическим аспектом расшифровки молекулярных механизмов реализации локального и системного воспаления при ХОБЛ [13]. В условиях гипоксии происходит изменение работы дыхательной цепи, возрастает уровень сукцината в крови и тканях и значение вклада сукцинатоксидазного окисления в общее дыхание [14]. На клеточно-молекулярном уровне индукция перечисленных выше патологических процессов приводит к нарушениям ультраструктуры и функции важной клеточной органеллы – митохондрии, к дисбалансу ферментов энергетического обмена клеток, представленных сукцинатдегидрогеназой и лактатдегидрогеназой [15]. Показателем активности митохондриального дыхания считается сукцинатдегидрогеназа (СДГ), а показателем одного из восстановительных путей биосинтеза гликолиза – лактатдегидрогеназа (ЛДГ), которая отражает взаимопревращение молочной и пировиноградной кислот. В условиях гипоксии тканей восстановительные процессы начинают отставать от восполнения затрат, и это формирует дополнительный порочный метаболический круг развития патологии на уровне клеточного дыхания [15]. При повреждениях митохондрий отмечена также активация моноцитов и нейтрофилов, участвующих в воспалительных процессах [16]. В работах S.E Weinberg с соавт. [17] было показано, что митохондриальный аэробный гликолиз необходим для активации Т-клеток посредством генерации митохондриальных АФК, необходимых для оптимальной активности ядерного фактора активированных Т-клеток. Также было отмечено, что белок митохондриальной противовирусной передачи сигнала играет одну из важных ролей в патогенезе ХОБЛ, поддерживая внутриальвеолярное воспаление, повышенные уровни протеаз и цитокинов, нарушение регуляции продукции активных форм кислорода АФК [18]. На сегодняшний день расширяется круг доказательств важной роли ферментов энергетического обмена клеток, обусловливающих митохондриальную дисфункцию, в патогенезе заболеваний различных органов и систем [19, 20]. Частые обострения ведут к прогрессированию клинических симптомов, ухудшению качества жизни, снижению эффективности проводимой терапии. Таким образом, становится актуальной задача по определению особенности клинико-иммунологических показателей и уровня ферментов энергетического обмена клеток у пациентов ХОБЛ с частыми обострениями в период ремиссии для разработки индивидуальных программ профилактики очередных обострений.
Цель исследования – оценить клинико-иммунологические показатели и показатели ферментов энергетического обмена клеток у пациентов ХОБЛ с частыми обострениями в сравнении с пациентами ХОБЛ, имеющими редкие обострения.
Материалы и методы исследования
Исследование проводилось с 2020 по 2022 г. на базе Больницы ПНЦ РАН, ИФПБ РАН и ИТЭБ РАН в рамках госзадания № 075-01406-20-01 по программе 0576-2020-0006, одобренной локальным этическим комитетом Б ПНЦ РАН, протокол № 16 от 20.11.2019 г.
Все пациенты, включенные в исследование, подписывали информированное согласие.
Критериями включения в исследование явились: стабильное состояние в течение предшествующих четырех недель у пациентов с ХОБЛ 2 стадии по спирометрическим показателям, отсутствие острых инфекционных заболеваний любой этиологии и локализации, острой и тяжелой хронической дыхательной и сердечно-сосудистой недостаточности, нарушения ритма, перенесенные сосудистые катастрофы (острый инфаркт миокарда и острое нарушение мозгового кровообращения), пневмония, туберкулез легких, бронхиальная астма, злокачественные заболевания любой локализации, беременность, оперативные вмешательства, отказ от исследования.
Под динамическим наблюдением находились 162 пациента с верифицированным диагнозом ХОБЛ, который был установлен согласно Международной программе «Глобальной инициативы по ХОБЛ (GOLD-2019)», Клиническим рекомендациям Российского респираторного общества, 2019 г., под ред. А.Г. Чучалина [1, 2].
Возраст пациентов от 40 до 75 лет. Согласно критериям включения в первую группу наблюдения вошли 48 пациентов с ХОБЛ 2 ст., которые имели документально подтвержденные частые обострения. Вторую группу (n = 62) составили пациенты с ХОБЛ 2 ст., имеющие редкие обострения. В группу контроля (n = 28) были включены условно здоровые пациенты, не курящие и не имеющие клинико-лабораторного и инструментального подтверждения патологии со стороны верхних и нижних отделов органов дыхания. Всем пациентам проводилось в динамике, в течение двух лет, общеклиническое, лабораторное обследование, КТ органов дыхания, оценка показателей функции внешнего дыхания, проба с сальбутамолом 400 мкг на спирографе «SpiroLab III» (MIR, Италия) и на аппарате «Валента» (Санкт-Петербург, Россия) путем анализа кривой «поток-объем» и оценки показателей ОФВ1 и ОФВ1/ФЖЕЛ, проба с 6-минутной дозированной ходьбой (6MWD), м, определялась сатурация кислорода (SaO2). Для оценки степени обратимости обструкции использовалась проба с β2-агонистом короткого действия (сальбутамолом – 400 мкг). ОФВ1 измеряли до и через 15 мин после ингаляции препарата. Увеличение ОФВ1 через 15 мин больше 15 % от исходного свидетельствовало об обратимости обструкции [1]. Степень выраженности одышки оценивалась по шкале mMRC, симптомы заболевания – по вопроснику CAT (COPD Assessment Test – оценочный тест по ХОБЛ) [1, 2].
Маркеры воспаления: СРБ определяли количественным иммунотурбодиметрическим методом с использованием набора реагентов «ДДС» (Россия) на биохимическом автоматическом анализаторе BS-400 Mindray (КНР); фибриноген – методом Клаусса; провоспалительные цитокины (IL-1β, IL-6, IL-8, TNF-α) – с помощью иммуноферментного анализатора MULTISKAN FC (Thermo Scientific Microplate Reader, США) по методике, прилагаемой к тестовым системам ЗАО «Вектор Бест», г. Новосибирск. Показатели ферментов энергетического обмена клеток (СДГ и ЛДГ) изучали цитобиохимическим методом в лимфоцитах периферической крови [3].
Статистическая обработка проводилась с использованием компьютерной программы Statistika 6.0. Рассчитывалось среднеарифметическое (±) стандартное отклонение (M±SD). Дальнейшую обработку результатов проводили с применением анализа t-теста Стьюдента. Для оценки степени корреляции использовали критерий корреляции Пирсона (г). Различия считались статистически значимыми при р < 0,05.
Результаты исследования и их обсуждение
Пациенты всех групп наблюдения были сравнимы по полу, возрасту, длительности заболевания. Средний возраст составил в 1 гр. – 54,4±3,11 года, во 2 гр. – 55,8±1.81 и в группе контроля – 54,6±1,26. Длительность заболевания ХОБЛ – соответственно 12,08±3,83 и 11,06±2,69 лет. Среднее число обострений ХОБЛ по данным медицинской документации у пациентов 1 гр. было равно 2,6± 0,14 случаев в год и для пациентов 2 группы наблюдения – 0,8±0,16. Активно курили 36 пациентов 1 гр. – 22,4±1,8 пачко/лет и 47 пациентов 2 гр. – 14,7±1,6 пачко/лет. Медикаментозную терапию все пациенты с ХОБЛ 2 ст. до момента включения в исследование получали нерегулярно, в основном комбинированные бронходилататоры короткого действия, антихолинергические препараты короткого действия. При обострении заболевания назначались по показаниям антибиотики по стандартным схемам лечения, предусмотренные GOLD (пересмотр 2018 г.), муколитики и глюкокортикостероиды через небулайзер и/или внутривенно [1].
С 2020 г. пациентам была назначена терапия комбинированными препаратами длительного действия ДДАХ/ ДДБА (ДДАХ – длительно действующие антихолинергики и ДДБА – длительно действующие β2-агонисты). В период ремиссии существенной разницы в показателях функции внешнего дыхания у пациентов групп наблюдения выявлено не было, соответственно 63,4±4,9 и 66,7±3,8 %D. Пациенты 1 гр. наблюдения в 67 % случаев предъявляли жалобы на кашель с мокротой, и у них диагностировался преимущественно бронхитический фенотип ХОБЛ, в то время как у 78 % пациентов 2 гр. наблюдения чаще беспокоила одышка и диагностировался преимущественно эмфизематозный фенотип. Примечательно, что сатурация кислорода у пациентов 2 гр. в период ремиссии и тест с 6-минутной дозированной ходьбой оставалась низкой и практически не отличалась от показателей пациентов 1 гр., что указывало на сохранение гипоксии у них даже в период ремиссии (табл. 1).
В анализах крови по общепринятым маркерам воспаления (количество лейкоцитов, СРБ, уровень фибриногена) отличий установлено не было. В то же время в периферическом анализе крови у пациентов 1 гр. в 58 % случаев выявлялась лимфопения и умеренно выраженная эозинофилия как в период обострения, так и в период ремиссии (табл. 2).
Таблица 1
Показатели степени выраженности одышки, симптомов заболевания, сатурации кислорода, функциональных резервов организма при ХОБЛ
|
Показатель |
ХОБЛ с частыми обострениями 1 гр. (n = 48) |
ХОБЛ с редкими обострениями 2 гр. (n = 62) |
Контроль (n = 28) |
||
|
Период обострения |
Период ремиссии |
Период обострения |
Период ремиссии |
||
|
Одышка по шкале mMRC |
3,02±0,22 |
1,92±0,09 |
2,13±0,71 |
1,04±0,06 |
0 |
|
SaO2 |
94,44±1,87 |
96,07±1,56 |
94,22±0,54 |
96,81±0,12 |
98,01±0,12 |
|
САТ-тест, баллы |
26±7 |
21±2 |
23±+3 |
17±+1 |
0–10 баллов |
|
Тест 6МWT |
304,6±9,2 м |
344,9±6,7 |
334,6±9,2 м |
349,9±6,7 |
576,2±6,8 |
Р < 0,005.
Таблица 2
Показатели крови у пациентов с ХОБЛ
|
Показатели |
Хобл с частыми обострениями, n = 48 |
Хобл с редкими обострениями в стадии ремиссии, n = 62 |
Группа контроля, n = 28 |
||
|
В стадии обострения |
В стадии ремиссии |
В стадии обострения |
В стадии ремиссии |
||
|
Лимфоциты, абс. количество |
1,1±0,32 |
1,6±0,91 |
2,,4±1,02 |
2,7±0,85 |
2,8±1,45 |
|
Эозинофилы, кл/мкл |
119,6±12,41 |
102,2±23,12 |
73,2±14,21 |
68,04±12,84 |
45,83±23,12 |
|
СРБ (реф. зн. 0–5 мг/дл) |
6,85±+5,05 |
4,88±+1,91 |
5.89±+0.97 |
2,79±+0,14 |
0.22±+0,07 |
|
Фибриноген г/л |
4,88±+0,16 |
3,12±+0,92 |
4,07±+0,87 |
3,72 ±+ 0,19 |
3,43±+0,24 |
Р < 0,005.
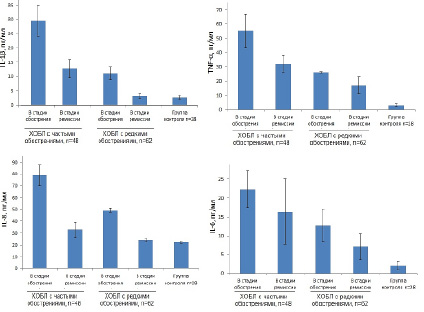
Рис. 1. Уровень провоспалительных цитокинов у больных ХОБЛ с частыми обострениями и больных ХОБЛ с редкими обострениями в период ремиссии и обострения
Среди признанных биомаркеров воспаления по данным литературы считается повышение уровней IL-6, TNF-α, IL-8, IL1β, CРБ, фибриногена в период обострения воспалительного процесса [21, 22]. Данные исследования продукции провоспалительных цитокинов в сыворотке крови пациентов с ХОБЛ двух групп наблюдения в период обострения и в период ремиссии представлены на рис. 1.
Из представленных данных видно, что в период обострения уровень всех провоспалительных цитокинов: TNF-α, IL-6, IL-8, IL1-β – был выше по сравнению с периодом ремиссии и с контролем, как в группе пациентов с частыми обострениями, так и в группе пациентов с редкими обострениями, что указывало на выраженность воспалительного процесса. Примечательно, что такая же закономерность оставалась и у пациентов группы ХОБЛ с редкими обострениями не только в период обострения, но и в период ремиссии. Так, в период ремиссии показатели TNF-α в группе пациентов с редкими обострениями превышали контрольные значения в 5,4 раза, IL-6 в 3,5 раза, IL-8 в 1, 09 раза и IL-1-β в 1,14 раза соответственно, при p < 0,05. Известно, что повышенные количества TNF-α, IL-6, IL-8 поддерживают системное воспаление, а IL-1β повышает хемотаксис, проницаемость сосудистой стенки, запускает реакции воспалительно-регуляторного каскада, стимулируя синтез коллагена, что способствует более раннему снижению функции внешнего дыхания и формированию фиброза [21, 22].
В группе пациентов с частыми обострениями, у которых определялись повышенные значения TNF-а и IL-6 в период ремиссии, активность ЛДГ и СДГ оставалась повышенной на 30 % и 20 % по сравнению с контрольной группой, что указывало на более выраженную активность воспалительного процесса и угрозу очередного обострения. Принципиальные отличия наблюдались в группе пациентов с редкими обострениями, у которых были выявлены более значимые изменения уровня ферментов СДГ и ЛДГ по сравнению с маркерами воспаления. Если маркеры воспаления в период ремиссии незначительно превышали показатели значений в контрольной группе, то активность СДГ и ЛДГ была ниже показателей контрольной группы. Активность СДГ при этом оставалась значительно сниженной по сравнению с группой контроля, что указывало на сохраняющуюся гипоксию тканей у больных ХОБЛ с редкими обострениями в период ремиссии. Корреляционный анализ между показателями сатурации кислорода, провоспалительным цитокином IL-6 и ферментами энергетического обмена клеток у пациентов ХОБЛ с редкими обострениями показал, что чем ниже была сатурация кислорода и выше активность IL-6, тем ниже были показатели ферментов энергетического обмена клеток. На рис. 2 и 3 представлена корреляционная зависимость между SaO2, СДГ и ЛДГ.
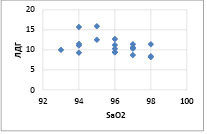
Рис. 2. График корреляционной связи между SaO2 и ЛДГ у пациентов 2 гр. наблюдения Коэффициент корреляции – -0,40455
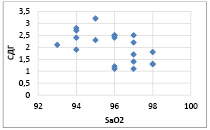
Рис. 3. График корреляционной связи между SaO2 и СДГ у пациентов 2 гр. наблюдения Коэффициент корреляции – -0,53255
Из представленных результатов видно, что наиболее выраженная корреляционная зависимость была установлена между показателями SaO2 и СДГ (r = -0,53255 при p < 0,05) и между SaO2 и ЛДГ(r = -0,40455 при p < 0,05) у пациентов с редкими обострениями.
Такая же закономерность прослеживалась и у пациентов с ХОБЛ с частыми обострениями, что подтверждает значение гипоксии в патогенезе ХОБЛ.
Таким образом, ХОБЛ с частыми обострениями чаще встречается у пациентов с бронхитическим фенотипом и характеризуется более выраженными изменениями функциональных, иммунологических и метаболических показателей по сравнению с пациентами ХОБЛ с редкими обострениями. В период ремиссии пациенты ХОБЛ с редкими обострениями сохраняли активность маркеров воспаления и сниженные показатели ферментов энергетического обмена, что указывало на угрозу очередного обострения. Чем ниже были значения СДГ, тем чаще возникали обострения ХОБЛ.
В патогенезе ХОБЛ ведущая роль принадлежит системным эффектам воспаления и окислительному стрессу. На клеточно-молекулярном уровне индукция перечисленных выше патологических процессов и хроническая гипоксия тканей могут нарушать ультраструктуру и функционирование важной клеточной органеллы – митохондрии.
При снижении доставки кислорода к митохондриям в клетках происходит нарушение активности ферментов энергетического обмена. Выявленные особенности маркеров воспаления и ферментов энергетического обмена клеток позволят расширить представления о патогенезе ХОБЛ и могут стать основанием для выявления новых потенциальных биомаркеров (СДГ и ЛДГ), которые смогут быть использованы для уточнения прогноза и подбора индивидуальной терапии.
Библиографическая ссылка
Косякова Н.И., Акуленко М.В., Прохоренко И.Р. КЛИНИКО-ИММУНОЛОГИЧЕСКИЕ ОСОБЕННОСТИ И ФЕРМЕНТЫ ЭНЕРГЕТИЧЕСКОГО ОБМЕНА КЛЕТОК ПРИ ХОБЛ С ЧАСТЫМИ ОБОСТРЕНИЯМИ // Международный журнал прикладных и фундаментальных исследований. 2022. № 8. С. 25-31;URL: https://applied-research.ru/ru/article/view?id=13422 (дата обращения: 07.03.2026).
DOI: https://doi.org/10.17513/mjpfi.13422

