Введение
Эндогенная интоксикация (ЭИ) может, как сопровождать самые разные виды заболеваний, так и выступать в качестве самостоятельного синдрома [17], усугубляя течение сопутствующих заболеваний.
В последние годы имеется тенденция к универсализации синдрома ЭИ и его неспецифичности [9]. Детальное изучение клинических и лабораторных изменений позволило выявить наличие синдрома и при значительно более благоприятно протекающих заболеваниях [28], при которых ЭИ не представляет угрозы, но значительно ухудшает качество жизни больных: при неосложненном инфаркте миокарда и ишемической болезни сердца [7], в педиатрической практике [5], у пожилых [23, 18], деформирующем остеоартрозе [19] и т. д. На современном этапе хронические дерма тозы рассматриваются в некоторой степени и как экзотоксическая патология. Усугубление тяжести заболевания, его торпидное течение закономерно отмечаются на фоне разбалансированности биохимического и иммунологического гомеостаза вследствие нарушения процессов пролиферации, повреждения клеточных мембран и изменения их проницаемости, накопления в крови ЦИКидр. [10, 4].
Синдром эндогенной интоксикации относится к числу наиболее распространенных в клинической практике и наблюдается при самых различных, этиологически и патогенетически нетождественных состояниях [6, 15, 26].
Изучение системы крови, метаболизма, нейроэндокринной регуляций и иммунитета у пациентов в состоянии хронической интоксикации обнаруживает сдвиги гомеостаза, характерные для хронического стресса с соответствующим снижением резистентности организма. Попадающие в организм соединения и внутренние метаболиты подвергаются детоксикации. Знание принципа реакций, лежащих в основе этого процесса, важно для понимания стратегии дальнейшей коррекции эндотоксичности [12]. Знание этих механизмов лежит в основе поиска функциональнодиагностических приемов оценки эндотоксичности, а также разработки подходов к коррекции терапии. В последнее время в диагностике ЭИ важное место отводится определению веществ среднемолекулярной массы [10]. Это обусловлено тем, что в состав веществ среднемолекулярной массы входят продукты катаболизма белков, олигосахара, производные глюкуроновых кислот, нуклеотиды, биологически активные вещества, которые сами могут оказывать повреждающее и токсическое воздействие на мембраны клеток, увеличивать проницаемость сосудов, вызывать тканевую гипоксию [12].
В связи с этим большое значение для диагностики эндотоксикоза придается лабораторным исследованиям.
Клинике, патогенезу и лечению ЭИ посвящено в последние годы большое количество публикаций, в том числе обзорного характера [9, 11, 16, 20].
Клинические проявления симптомокомплекса ЭИ малоспецифичны и характеризуются общей слабостью, чувством разбитости, нарушениями сна и аппетита, мышечными и головными болями и т. д. [8, 11].
В последние годы в иностранной литературе достаточно широкое распространение получила оригинальная концепция сущности синдрома ЭИ: возникновение системного (генерализованного) воспаления (systemic inflammatory response syndrome - SIRS) [21, 22], к которому могут привести такие различные патологические процессы, как тканевая деструкция и выраженная гипоксия тканей, хроническое отравление.
В начале процесса токсины и метаболиты поступают в кровь, лимфу, интерстициальную жидкость и распространяются из патологического очага (воспаление, травмированные ткани, опухоли и т. д.). Если защитные системы организма в состоянии обезвредить эти вещества, клинической симптоматики может и не возникнуть, хотя при любом патологическом состоянии, возможно, существует скрытый или транзиторный эндотоксикоз - так называемая нулевая стадия. При декомпенсации защитных и регуляторных систем - выделительной, детоксикационной (микросомального окисления, конъюгации), мононуклеарномакрофагальной, начинается накопление эндогенных токсинов в организме - стадия накопления продуктов первичного аффекта.
Ряд авторов [9] выделяют три компонента ЭИ: микробиологический, биохимический, иммунологический. Среди патологических биохимических процессов большое внимание уделяется активации протеолиза с нарушением общего ферментативного гомеостаза организма, причем отмечается прямая корреляция уровня протеолитической активности крови с такими интегральными маркерами синдрома ЭИ как лейкоцитарный индекс интоксикации, циркулирующие иммунные комплексы. Молекулы средней массы, большинство авторов считает универсальным маркером ЭИ. Важным патофизиологическим механизмом развития эндотоксикоза является активация процессов перекисного окисления липидов, инициируемых свободными кислородными радикалами.
При ЭИ наблюдаются выраженные изменения иммунного статуса, проявляющиеся, как правило, иммунодепрессией [9, 14]. Ключевую роль в развитии синдрома играют активированные нейтрофилы [24, 28] и медиаторы различных типов. В последние годы принято считать, что повышенный уровень СМ в крови отражает степень эндотоксикоза [11].
Учитывая вышесказанное, следует подчеркнуть неспецифичность синдрома ЭИ, возникающего при столь различных по этиологии, патогенезу, клиническим проявлениям и тяжести заболеваниях.
Длительное воздействие факторами, напрягающими гомеостаз, переводит организм на низкие уровни реактивности. Таким образом, экология современного человека характеризуется реализацией реакций низких уровней [26]. При эндогенной интоксикации перед организмом стоит задача - сохранение нормального гомеостаза и его оптимизация. С возрастом начинается процесс снижения чувствительности, реактивности, связанный с большими психоэмоциональными, эндоэкологическими и другими нагрузками. По выражению В. М. Дильмана, начинает работать «закон отклонения гомеостаза» (1986). Организм вынужден «выбирать» в качестве управляющих факторов (т. е. факторов, вызывающих развитие определенной адаптационной реакции) все большие по абсолютной величине воздействия.
Наше внимание привлекает то общее, что объединяет все народы планеты, общая беда - экологический кризис, печальный вклад которого в формирование хронических неинфекционных заболеваний трудно переоценить.
Ожирение является распространенным нарушением обмена веществ и серь езной социальной проблемой в экономически развитых странах.
В основе ожирения лежит энергетический дисбаланс, который часто сочетается с факторами риска сердечнососудистой патологии - гипертонией, гипертриглицеридемией, инсулинорезистентносты и другими метаболическими расстройствами.
Целью работы явилось комплексное изучение признаков эндогенной интоксикации у лиц с ожирением и состояния адаптационных реакций организма.
Материал и метод
Обследовали 100 пациентов с различной степенью выраженности ожирения в возрасте от 20 до 64 лет. Средний возраст - 41 ± 8,8 год. Мужчин - 16, женщин - 84. Контрольную группу составили 50 здоровых в возрасте от 22 до 55 лет. Чтобы оценить степень накопления жировой массы тела, рассчитывался индекc Кетле, как отношение массы тела, вы раженной в килограммах, к росту, выраженному в метрах, возведенному в квадрат, т. е. индекс Кетле = МТ (кг) / Рост (м2).
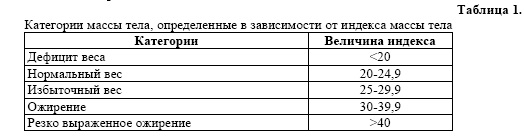
Расчет лейкоцитарной формулы определение адаптационных реакций осуществлялись согласно рекомендациям Гаркави Л. X. с соавт. [2].
Иммунологический профиль оценивался по показателям неспецифической и реактивности организма, т. е. по уровню иммуноглобулинов основных классов А, М, G в сыворотке крови, рассчитывался индекс интоксикации.
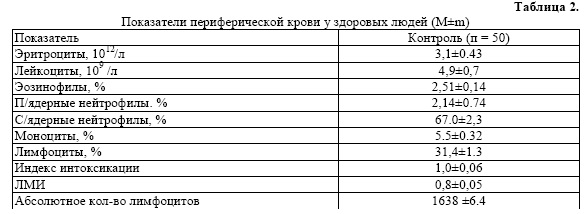
- 7%, лимфоцитов - 53%, ИИ - 5,7 при физиологическом колебании до 1,5, ЛМИ
- 1,8 и абсолютное количество лимфоцитов - 4590.
У всех мужчин с ожирением в предреабилитационном периоде зарегистрирован высокий ИИ от 2,098 до 7,0 со значительной тенденцией уменьшения абсолютного количества лимфоцитов до 1520±4,7.
Предельное количество эритроцитов у мужчин с АГ составляет 5,3.1012/л, лейкоцитов - 10,3 109/л, эозинофилов - 10%, с/я нейтрофилов - 73%, моноцитов
- 13%, лимфоцитов - 52%, ИИ - 7 при физиологическом колебании до 1,5, ЛМИ
- 0,9 и абсолютное количество лимфоцитов - 2952.
Таким образом, исходный высокий ИИ у мужчин и женщин с ожирением является критерием, отражающим нарушения адаптационных систем, требующих мониторирования при проведении эндоэкологическои реабилитации.
При анализе клинических показателей у больных с ожирением (n = 100) наиболее информативными были: увеличение массы тела у 100%, ухудшение памяти у 94%, общая слабость у 85%, одышка у 76%, головная боль 66%, нарушение сна у 65%, нарушение функции кишечника 58% и 40% пациентов отмечали нарушение аппетита (таблица 3).
Данные признаки должны быть учтены при проведении комплексной эндоэкологическои реабилитации у лиц с избыточной массой тела.
Проведен анализ содержания основных классов иммунной системы у пациентов с ожирением.
Изучение гуморального иммунитета у больных с АГ в состоянии адаптации имеет не только диагностическое, но и прогностическое значение.
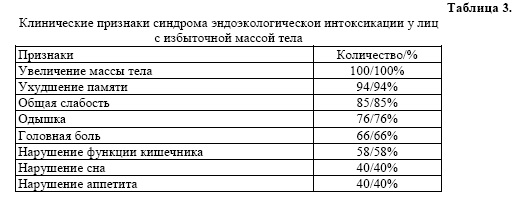
Анализ иммунологических показателей у женщин с ожирением показал наличие дисиммуноглобулинемии (таблица 4).
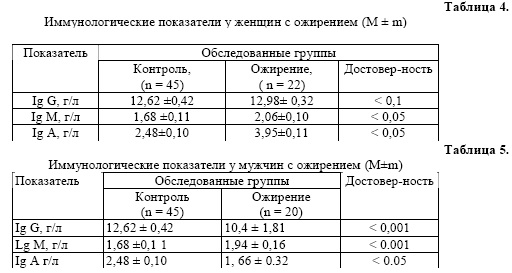
Как видно из таблицы 5, исследования иммунологических показателей у мужчин с ожирением (n=20) выявил дисиммуноглобулинемию за счет IgG, IgM и IgA (р < 0,001).
В последние годы большой научный и практический интерес вызывают вопросы диагностики сложного сочетания нарушений углеводного, липидного и других видов метаболизма и обсуждение их роли в патогенезе ожирения.
При ожирении, вне зависимости от его происхождения, наблюдаются типичные изменения: усиливается образование триглицеридов, гипертрофируются жировые клетки, увеличиваются липолиз в жировой ткани и поступление неэстерифицированных жирных кислот в печень, что приводит, в свою очередь, к повышению синтеза триглицеридов и ЛПОНП, увеличивается общий холестерин (таблица 6).
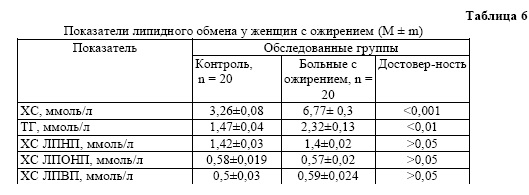
Как видно из таблицы 6, у женщин с ожирением отмечалось по сравнению с контрольной группой достоверное увеличение уровня ХС (6,77±0,3 ммоль/л, Р<0,001) и ТГ (2,32±0,13 ммоль/л, Р<0,01), а ХС ЛПНП, ХС ЛПОНП, ХС ЛПВП находились в пределах физиологических колебаний и составляли 0,83 ± 0,07 ммоль/л (Р>0,05), 1,4±0,02 ммоль/л (Р>0,05),
0,57±0,02 ммоль/л (Р>0,05), 0,59±0,024 ммоль/л (Р>0,05) соответственно. Полученные результаты позволяют предположить, что данные показатели отражают сохранность адаптационных механизмов на уровне целостного организма и могут служить критериями стадии адаптации при ожирении.

У мужчин с ожирением (таблица 7) отмечаются изменения в липидном спектре крови в сторону увеличения ХС (7,02±0,12 ммоль/л, Р<0,01) и ТГ (2,06±0,08 ммоль/л, Р<0,01) с незначительным увеличением ХС ЛПНП, ХС ЛПОНП и ХС ЛПВП (2,13±0,07 ммоль/л, Р>0,05; 1,86±0,017 ммоль/л, Р>0,05; 0,77±0,02 ммоль/л, Р>0,05; 1,29±0,024 ммоль/л, Р>0,05 соответственно).
Ожирение можно рассматривать как интегративный «черный ящик», где имеют место многие хронические заболевания.
Ведущая роль в адаптивной самоорганизации различных функций организма принадлежит его разнообразным жизненно важным и в первую очередь метаболическим потребностям. Именно потребности первично объединяют разнообразные молекулярные процессы и ткани в системные организации, обеспечивающие удовлетворение этих потребностей [3]. Каждый из действующих на организм раздражителей характеризуется количеством и качеством. Развившиеся в процессе эволюции общие приспособительные реакции организма являются неспецифическими. А специфика, качество каждого раздражителя накладывается на общий неспецифический фон. В настоящее время известны четыре адаптационные реакции: стресс, повышенная активация, спокойная активация и реакция тренировки (15).
В связи с этим изучение общих неспецифических адаптационных реакций у лиц с ожирением с целью разработки комплексной программы реабилитационных мероприятий имеет важное практическое значение.
У обследованных пациентов с ожирением выявленные исходно адаптационные реакции представлены в таблице 8.
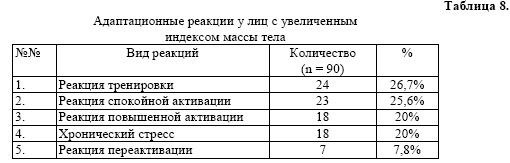
Таким образом, у лиц с ожирением имеют место разные адаптационные реакции.
У 24 пациентов (26,7%) выявлена реакция тренировки, которая представляет собой общую неспецифическую адаптационную реакцию, развивающуюся в ответ на разные по качеству слабые раздражители, и характеризуется определенными значениями форменных элементов белой крови: в среднем число лимфоцитов - 23,6, количество с/я нейтрофилов - 67, л/нся - 0,35, ИИ - 2,84; у 8 (28,6%) выявлен высокий уровень реактивности, у 6 (21,4%) - средний уровень, у 14 (50%) - низкий уровень реактивности («высокий этаж»).
Реакцию спокойной активации имели 23 пациента (25,6%); при этом количество лимфоцитов - 30, нс/я - 57, коэффициент л/нся - 0,53, ИИ - 1,89; в данной группе отмечается высокий уровень реактивности у 16,7%, средний - у 29,2%, низкий уровень - у 54,2% («высокий этаж»).
Реакция повышенной активации (18 человек - 20%) характеризуется наличием лимфоцитов - 41, нся - 56, л/нся - 0,73, ИИ - 1,37; у пациентов в этой группе высокий уровень реактивности зарегистрирован у 16.7%. средний уровень - у 37,5%, низкий уровень - у 33,3%.
При хроническом стрессе (18 - 20%) высокий уровень реактивности выявлен у 35%, средний уровень у 50%, низкий 15%.
Заключение
Пациенты с ожирением в сочетании синдромом эндогенной интоксикации имеют в предреабилитационном периоде неадекватные адаптационные реакции. Отмечено, что во всех группах лишь одна треть имеет высокий уровень резистентности организма, тогда как суммарно средний и низкий уровни резистентности составили более 80%, что является достаточно обоснованным критерием для проведения комплексных эндоэкологических реабилитационных мероприятий. Резюме
В результате исследования пациентов разного пола с ожирением установлено, что синдром ожирения сопровождается выраженными признаками эндотоксикоза. Авторы полагают, что наличие эндотоксикоза нарушает адаптивные реакции организма, что было подтверждено при их объективной оценке. Выявленные нарушения требуют коррекции при проведении реабилитационных мероприятий у этой категории пациентов.
СПИСОК ЛИТЕРАТУРЫ:
1. Владимиров Ю. А., Азизова О. А., Деев А. И. и др. Свободные радикалы в живых системах. Итоги науки и техники. Биофизика. - 1991; 29: 1 250.
2. Гаркави Л. X. И соавт. Повышение сопротивляемости организма с помощью адаптационных реакций тренировки и активации на разных уровнях реактивности организма. Методические рекомендации. - РостовнаДону, 1985.
3. Гаркави Л. X. и соавт. Антистрессорные реакции и активационная терапия. - М.: «ИМЕДИС», 1998. - С. 16.
4. Долгушин И. И., Эберт Л. Я., Лифшиц Р. И. Иммунология травмы. - Свердловск, 1989. - С. 269.
5. Иванова И. Л., Лучанинова В. Н., Гнеденкова Л. Г. Исследования биологических жидкостей у детей с заболеваниями респираторной системы // Клин. лаб. диагностика. - 1992, № 7-8. - С. 4547.
6. Ковалев Г. И., Томников А. М., Музлаев Г. Г. Взаимосвязь эндогенной интоксикации и иммунодепрессии в патогенезе черепномозговой травмы. // Неврол. и психиатр, им. С. С. Корсакова. 1995. Т. 95, № 6. С. 45.
7. Копытова Т. В., Добротина Н. А., Боровков Н. Н. и др. Значение среднемолекулярных пептидов сыворотки крови при острых формах ишемической болезни сердца // Лаб. дело. - 1991, № 10.С. 1821.
8. Ларионова В. Б. Использование антиоксидантов в комплексной интенсивной терапии у больных раком легких. Автореф дис. докт. мед. наук. М., 1990. - 36 с.
9. Макарова Н. П., Коничева И. Н. Синдром эндогенной интоксикации при сепсисе // Анестезиол. и реаниматол. - 1995. - № 6. С. 46.
10. Малахова М. Я. Метод регистрации эндогенной интоксикации. Пособие для врачей. СПб.: МАЛО, 1995. - С. 3350.
11. Николаичик В. В., Мои и В. М., Кирковский В. В. и др. Способ определения «средних молекул»//Лаб. дело. - 1991, № 10.С. 1318.
12. Оболенский С. В., Малахова М.Я., Ершов А. Л. Диагностика стадий эндогенной интоксикации и дифференцированное применение методов эфферентной терапии // Вестник хирургии. - 1991, № 3. С. 95100.
13. Ромоданом А. Л., Лисяный Н. И. Черепномозговая травма и иммунореактивность организма. - Киев, 1991.
14. Судаков К. В . Теория функциональных систем //Под ред. Б. П1. Нувахова. М., 1996. С. 89.
15. Чаленко В. В., Кутушев Ф. X. Эндогенная интоксикация в хирургии // Вести, хир. им. И. И. Грекова. - 1990. - Т. 4. - С. 3-6.
16. Чаленко В. В., Кутушев Ф. X. Эндогенная интоксикация в хирургии // Вестн. хир. им. И. И. Грекова. - 1990. - Т. 4. - С. 8.
17. Эндогенные интоксикации. Тезисы международного симпозиума. СПб., 1994.
18. Adams J. D., Mukherjee J. S., Klaidman L. N., Ashamed K. Apoptosis and oxidative stress in the aging brain //Sixth Congress for the Internal Assotiation of Biomed. Gerontology. Tokyo, 1995; 4: 25.
19. Бшозецька См1ян С. I. Синдром eimpreHHoi штоксикаци як маркер мембраннодеструктивних з1ми при первинному ocTeoapTpo3i i його корекщя за допомочею ентеросорбенйв //Укра1нський кардюлопчний журнал 1995; Додаток, 94.
20. Bone R. S . Sepsis, sepsis syndiome and the systemic inflammatory response syndrome (SIRS). JAMA 1995; 273: 2, 155.
21. Bone R. S. Sepsis, sepsis syndiome and the systemic inflammatory response syndrome (SIRS). JAMA 1995; 273: 2, 156.
22. Bone R. S. Toward a theory regarding the pathogenesis of the systemic inflammatory response syndrome: what we do and not know about cytokine regulation// Crit. Care. Med. 1996; 241: 163 172.
23. Carney J. M., Butter field D. A. Involvement of oxidative stress in aging and ageassociated neurodegenerative conditions /Sixth Congress for the Internal Assot. of Biomed. Geront Tokyo, 1995;
24. Fujishima S., Aikava N. Neutrophil - mediated tissue injury and its modulation//Intens. Cara Med. 1995; 21: 3, 277 285.
25. Garkavi L., Kvakina E., Shikhlyarova A. et al., 1995. and oth. A new strategy for age assotiatcd diseases and rejuvenation: influece of small doses of neurotropic substances and biostimulants. Sixth Congress for the Internal Assotiation of Biomed. Gerontology. Tokyo, 1995; 77.
26. Harris В. H., Gel f and J. A. The immune response to trauma// Pediatr. Surg. 1995; 4: 2, 77 82.
27. Nathens А. В., Marshall J. С . Sepsis, SIRS, and MODS: what´s in a name? World J. Surg. 1996; 20: 4, 386 391.
28. Schlag G., Redl H. Mediators of injury and inflammation. World J. Surg. 1996; 20: 4, 406410.
Библиографическая ссылка
Уракова Т.Ю., Лысенкова Н.С. Эндогенная интоксикация и адаптационные возможности у пациентов с ожирением // Международный журнал прикладных и фундаментальных исследований. 2009. № 5. С. 39-0;URL: https://applied-research.ru/ru/article/view?id=149 (дата обращения: 11.02.2026).

