Эпоксидирование олефинов пероксидом водорода в двухфазных водно-органических системах с использованием метода межфазного катализа (МФК) представляет существенный интерес для селективного органического синтеза. При участии пероксогетрополисоединений вольфрама (VI) и фосфора (V), образующихся in situ, реализуется нерадикальный процесс окисления, что обеспечивает более высокую селективность образования эпоксида.
Высокая каталитическая активность при этом фосфорновольфрамовых гетерополисоединений обусловлена способностью атомов вольфрама при взаимодействии с пероксидом водорода образовывать циклические пероксокомплексы, а также специфическим влиянием атомов фосфора в промежуточных активных структурах.
Разработка активных каталитических систем для эпоксидирования непредельных соединений разбавленными водными растворами пероксида водорода, основанная на использовании двух перспективных подходов – метода межфазного катализа и катализа пероксогетерополисоединениями вольфрама (VI) и фосфора (V), является актуальной задачей. Это подтверждается тем, что, несмотря на значительные успехи в этой области исследований, большинство известных литературных методик не обеспечивают достаточно высокой эффективности и селективности процессов эпоксидирования различных субстратов.
Материалы и методы исследования
Для изучения каталитической активности пероксогетерополисоединений W(VI) и P(V) в зависимости от их состава и условий образования in situ в каталитических системах, были выбраны модельные реакции эпоксидирования циклогексена и аллилхлорида пероксидом водорода:
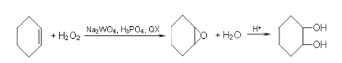 (1)
(1)
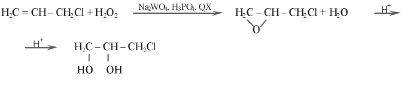 (2)
(2)
В качестве основного катализатора использовали комплекс Вентурелло Q3[PO4{W(O)(O2)2}4] [8] (обозначаемый также в виде Q3[PW4O24]), образующийся in situ. Эпоксидирование непредельных субстратов проводили в двухфазной водно-органической системе в присутствии фосфорно-вольфрамовых гетерополисоединений, которые формировались в водной фазе системы при смешивании водного раствора H2O2, Na2WO4 и H3PO4. В термостатируемый реактор, снабженный магнитной мешалкой (w=1200 об/мин) и обратным холодильником, при 323 К вносили навеску межфазного переносчика (Q+Х–), в качестве которого использовали цетилпиридиний бромид (ЦПБ), добавляли органическую фазу (оф) (органический растворитель – 1,2-дихлорэтан и субстрат). Затем вливали приготовленную водную фазу (вф), предварительно доведенную до определенного значения рН с помощью 30 %-ных растворов H2SO4 или NaOH. При необходимости разделение фаз после реакции достигалось путем центрифугирования. Объем смеси составлял 4 мл водной фазы и 2 мл органической фазы, содержащей 6,13 моль/л аллилхлорида или 4,94 моль/л циклогексена в 1,2-дихлорэтане.
Анализ продуктов эпоксидирования циклогексена и хлористого аллила проводили методом ГЖХ на газовом хроматографе «CHROM-5». По данным ГЖХ при эпоксидировании аллилхлорида основным продуктом реакции является 3-хлор-1,2-эпоксипропан (эпихлоргидрин), достаточно устойчивый к гидролизу с образованием 3-хлорпропандиола-1,2. При эпоксидировании циклогексена основным продуктом реакции является эпоксициклогексан, способный гидролизоваться в довольно кислых средах с образованием циклогександиола-1,2.
Результаты исследования и их обсуждение
В условиях межфазного катализа в системе Na2WO4/H2O2–H2O/H3PO4 формирование пероксогетерополианионов [PO4{WO(O2)2}4]3- происходит в водной фазе (in situ), затем они стабилизируются липофильными катионами межфазного переносчика (Q+) на поверхности раздела фаз (ПРФ) и переносятся в органическую фазу, где происходит взаимодействие пероксогетерополианионов с молекулами субстрата. Далее катализатор регенерируется пероксидом водорода в водной фазе. В [2] на примере эпоксидирования алкенов в присутствии одного из наиболее активных пероксосоединений Q3[PO4{WO(O2)2}4] была предложена следующая схема каталитического цикла:
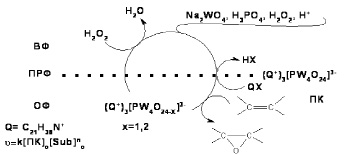
Схема 1. Каталитический цикл эпоксидирования (Q+ = C5H5N+C16H33)
В соответствии со схемой 1, использование каталитических реакций эпоксидирования непредельных соединений пероксидом водорода в двухфазных системах в условиях межфазного катализа в качестве метода исследования каталитической активности пероксогетерополисоединений возможно только при соблюдении некоторых условий.
Прежде всего, полный механизм процесса эпоксидирования включает стадию переноса пероксогетерополианионов из водной фазы в органическую и, следовательно, для обеспечения кинетического режима в двухфазных системах реакции должны протекать без диффузионных осложнений.
В данной работе кинетический режим процесса обеспечивался за счет интенсивного перемешивания системы со скоростью (w) 1200 об/мин. Как видно из рис. 1, при w ≥ 900 об/мин выходы эпоксидов при эпоксидировании аллилхлорида и циклогексена уже не зависят от интенсивности перемешивания системы. В этом случае для переноса реагентов между фазами применима модель экстракционного равновесия.
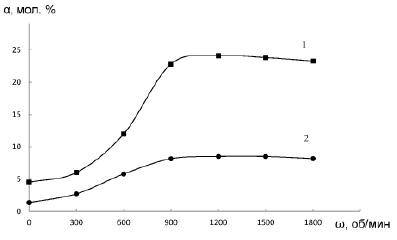
Рис. 1. Зависимости выхода эпоксида от интенсивности перемешивания, при эпоксидировании: 1 – циклогексена: (СNa2WO4)вф =0,05 М, (СH3PO4)вф = 0,0125 М, (СC6H10)оф = 4,94 М, (СЦПБ)оф = 0,036 М, рН = 2,25; 2 – аллилхлорида: (СNa2WO4)вф =0,075 М, (СH3PO4)вф = 0,019 М, (СC3H5Cl)оф= 6,13 М, (СЦПБ)оф = 0,056 М, рН = 1; Vвф = 4 мл, Vоф = 2 мл, (СH2O2)вф = 4,0 М, t = 50оС, τ = 1 час
Кроме того, скорость реакций не должна лимитироваться скоростью образования пероксогетерополисоединений или скоростью их регенерации (реокисления) пероксидом водорода в водной фазе. В связи с этим реакции необходимо проводить в присутствии избытка пероксида водорода, когда будет наблюдаться нулевой порядок реакции по H2O2. На рис. 2 представлены зависимости выходов эпоксициклогексана (кр.1) и эпихлоргидрина (кр.2) и соответствующих им диолов (кр. 1’,2’) от концентрации пероксида водорода в условиях, способствующих формированию in situ комплекса [C16H33C5H5N]3[PO4{WO(O2)2}4].
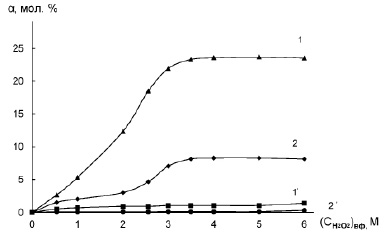
Рис. 2 Влияние концентрации пероксида водорода в водной фазе на выход эпоксидов (1,2) и диолов (1’, 2’) при эпоксидировании: 1, 1’ – циклогексена: (СNa2WO4)вф= 0,05М, (СH3PO4)вф= 0,0125 М, (СC6H10)оф= 4,94М, (СЦПБ)оф = 0,036 М, рН = 2,25; 2, 2’ – аллилхлорида: (СNa2WO4)вф= 0,075М, (СH3PO4)вф= 0,019М, (СC3H5Cl)оф= 6,13М, (СЦПБ)оф = 0,056 М, рН = 1; Vвф = 4 мл, Vоф = 2 мл, t = 50оС, ω = 1200 об/мин, τ =1 час
Согласно рис. 2, скорости реакций эпоксидирования субстратов возрастают с увеличением концентрации H2O2 в водной фазе, но при (СH2O2)вф ≥ 3М зависимости практически запределиваются.
В соответствии с литературными данными [3], определенный избыток H2O2 в каталитических системах необходим также для разрушения (предотвращения образования) пероксогетерополисоединений со структурой, подобной структуре фосфорновольфрамовой гетерополикислоты H3PW12O40 (ФВК), т.е. соответствующей насыщенному ряду по вольфраму (PW12) или с небольшим его нарушением (PW11, PW9).
В работе использовались водные растворы H2O2 c концентрацией 4,0 М и растворы Na2WO4 c концентрацией 0, 05 М. Таким образом, избыток пероксида водорода (СH2O2/СNa2WO4 ≈ 80) является более чем достаточным для полного разрушения структуры ФВК и образования пероксочастиц состава PW4. С другой стороны, при получении эпоксидов использование концентрированных водных растворов H2O2 (более 40 %), а также высоких температур (выше 65ºС) нежелательно, особенно, если субстрат используется без органического растворителя, так как при этом возможно образование побочных продуктов за счет окислительного расщепления непредельных соединений с образованием соответствующих карбоновых кислот [1, 4, 6, 7].
В связи с этим для проведения реакций эпоксидирования в условиях межфазного катализа использовались водные растворы пероксида водорода с концентрацией не более 10 % при температуре не выше 50ºС. Это позволило избежать образования побочных продуктов окислительного расщепления, что согласуется с данными [5], где показано, что в этих условиях окислительное расщепление линейных и циклических алкенов также не наблюдалось.
Для получения препаративных выходов эпоксидов возможно поэтапное добавление H2O2 (в виде концентрированного раствора) в систему по мере его расходования. Кроме того, метод МФК позволяет увеличить количество H2O2 в системе за счет увеличения соотношения объемов водной и органической фаз. В данной работе использовалось соотношение объемов фаз VВФ : VОФ= 2 : 1.
Следует отметить, что для оценки каталитической активности систем целесообразно использование начальных участков кинетических кривых, где кривые образования эпоксидов имеют подобный характер, т.е. до существенного накопления побочных продуктов (диолов) и торможения, связанного с уменьшением концентрации реагентов (H2O2, субстрата). В частности, при эпоксидировании аллилхлорида (рис. 3) даже в очень кислых средах (рН = 0,75-1,25) в течение первого часа реакции образование диола практически не наблюдается, и кривые имеют подобный характер. Поэтому для оценки каталитической активности систем использовался выход эпоксидов за 1 час реакции.
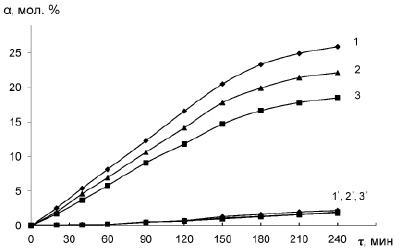
Рис. 3 Кинетические кривые образования эпихлоргидрина (1,2,3) и 3-хлоропандиола-1,2 (1’, 2’, 3’) при различных значениях рН водной фазы: 1,1’ – 1; 2,2’ – 0,75; 3,3’ – 1,25. Vвф = 4 мл, Vоф = 2 мл, (СNa2WO4)вф =0,075 М, (СH3PO4)вф = 0,019 М, (СH2O2)вф = 4,0 М, (СC3H5Cl)оф = 6,13 М, (СЦПБ)оф = 0,056 М, t = 50оС, ω = 1200 об/мин
Таким образом, в данной работе показано, что при эпоксидировании циклогексена и аллилхлорида в двухфазных системах (VВФ:VОФ = 2 : 1), (СH2O2)вф = 4,0 М, в присутствии межфазного переносчика, при интенсивном перемешивании (ω = 1200 об/мин) и при 50 ºС, скорость процесса определяется скоростью стадии эпоксидирования субстрата в органической фазе.
Библиографическая ссылка
Агейкина О.В., Метелева Г.П. ИССЛЕДОВАНИЕ КИНЕТИЧЕСКИХ ОСОБЕННОСТЕЙ РЕАКЦИИ ЭПОКСИДИРОВАНИЯ ЦИКЛОГЕКСЕНА И АЛЛИЛХЛОРИДА В ДВУХФАЗНЫХ СИСТЕМАХ // Международный журнал прикладных и фундаментальных исследований. 2015. № 2-1. С. 96-100;URL: https://applied-research.ru/ru/article/view?id=6384 (дата обращения: 15.02.2026).

