Введение
В течение последнего десятилетия, молекулярная цитогенетика сделала значительные шаги вперед, направленные на разработку технологий, которые способны обнаруживать геномные перестройки с недоступным ранее разрешением [1-4, 8-13]. В результате был обнаружен широкий спектр ранее неизвестных микроделеционных и микродупликационных синдромов [2, 4, 8, 12, 13]. Кроме того, были описаны многочисленные уникальные хромосомные (субхромосомные) аномалии, дающие значимую информацию относительно происхождения и последствий геномных перестроек [8, 9, 12]. Известно, что отдельные генные мутации, вариации числа копий ДНК (делеции/дупликации, анеуплоидии, транслокации) могут стать причиной геномной или хромосомной нестабильности (CIN), проявляющейся в виде структурных или численных изменений хромосом [1, 6, 7, 15]. В этом контексте описание случаев, в которых наблюдаются регулярные (немозаичные) генетические изменения и повышенный уровень соматических мутаций или CIN, имеют принципиальное значение [6, 15]. Сочетание молекулярно-цитогенетических методов исследования всего генома и отдельных клеток с биоинформатическим методом дает возможность связать геномные изменения с конкретной молекулярной или клеточной патологией [7].
Цель работы
Целью работы явилось исследование геномных аномалий у ребенка с умственной отсталостью, врожденными пороками развития и повышенным уровнем спорадической анеуплоидии (CIN) с помощью современных молекулярно-генетических методов сканирования генома.
Материалы и методы исследования
В настоящей работе было проведено цитогенетическое и молекулярно-цитогенетическое исследование клеточного материала мальчика в возрасте 1 года 3 месяцев с множественными пороками развития. Препараты метафазных хромосом получали из лимфоцитов периферической крови, культивируемых in vitro, стандартным методом. Цитогенетический анализ проводили на хромосомных препаратах с использованием светового микроскопа при увеличении х1125. Хромосомы идентифицировали при помощи метода дифференциального окрашивания хромосом по длине (G- и C-методы), который осуществлялся по общепринятому протоколу [1, 2]. Для определения частоты CIN, было проведено исследование методом флюоресцентной гибридизация in situ (FISH) с ДНК зондами на хромосомы 1, 7, 16, 17, 18, X и Y, как описано ранее [16]. Высокоразрешающее полногеномное сканирование при помощи SNP array проводили на ДНК, выделенной из лимфоцитов периферической крови с использованием системы платформы фирмы Affymetrix, Santa и чипов, состоящих из ~ 2,7 млн маркеров для оценки CNV и ~ 750000 для оценки SNP и программного обеспечения Affymetrix Chromosome Analysis Suite, описанного ранее [5,7]. Геномная локализация и гены, расположенные в перестроенных участках, были определены с помощью системы NCBI Build GRCh37/hg19 с эталонной последовательностью ДНК. Вариации числа копий исследовались с помощью биоинформатического анализа, описанного ранее [7].
Результаты исследования и обсуждения
Пациент исследовался в возрасте 1 года 3 месяцев из-за отставания в психомоторном развитии, нарушения зрения, снижения аппетита, срыгивания и малой прибавки в весе. Ребенок родился от первой беременности путем экстренного кесарева сечения в 34 недели в связи с признаками фетоплацентарной недостаточности плода. Масса тела при рождении была 1297г, длина – 38см; оценка по шкале Апгар составила 1/4 балла. При рождении отмечалась геморрагическая сыпь, тяжелая дыхательная недостаточность. На нейросонографии определялись признаки поликистозной дегенерации головного мозга. Мальчик с рождения находился на искусственном вскармливании, плохо прибавлял в весе, длительно сохранялись срыгивания пищей после кормления. При проведении компьютерной аудиометрии в возрасте 1 года выявлены признаки нейро-сенсорной двусторонней тугоухости II-III степени, при проведении ЭЭГ выявлена фокальная эпилептиформная активность в затылочно-теменно-височной области слева.
При обследовании мальчика в возрасте в 1 года 3 месяцев обращали на себя внимание следующие признаки: значительный дефицит массы тела и окружности головы (менее 3-й центили), множественные лицевые микроаномалии: долихомикроцефалия, высокий лоб, гипотелоризм глазных щелей, эпикант, длинный фильтр, низкопосаженные ушные раковины, гипоплазия эмали зубов. В неврологическом статусе отмечен левосторонний спастический гемипарез легкой степени, при этом тонус мышц в правых конечностях был снижен. Выявлено значительное отставание в психомоторном развитии: по шкале CAT/CLAMS коэффициент развития составлял менее 50%, что соответствует грубой задержке развития; при осмотре ребенка обращали на себя внимание постоянные стереотипные движения в виде постукивания рукой по голове; отсутствовала реакция на обращенную речь, не было интереса к игрушкам; речь представляла спонтанное монотонное гуление. Выявлены также атрофия зрительных нервов нисходящего генеза; сходящееся косоглазие, нистагм, катаракта слева; при проведении МРТ головного мозга обнаружена врожденная аномалия развития в виде гипоплазии мозолистого тела.
При проведении цитогенетического анализа у ребенка было обнаружено наличие CIN в виде анеуплоидии. На рис. 1 представлены результаты цитогенетического исследования мальчика. Кариотипы родителей были нормальными.
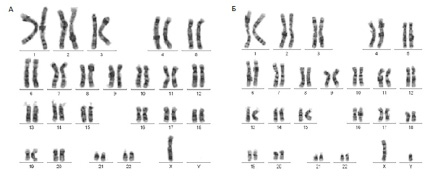
Рис. 1. Результаты цитогенетического исследования методом G – окрашивания (А – метафаза без хромосомы Y, Б – нормальны кариотип)
Для определения частоты CIN было проведено исследование методом флюоресцентной гибридизация in situ (FISH) с ДНК зондами на хромосомы 1, 7, 16, 17, 18, X и Y. Анализ FISH подтвердил наличие CIN (анеуплоидии) и показал, что частота соматических/спорадических хромосомных мутаций у пациента в 3-7 раз выше по сравнению с нормой, представленной в предыдущих исследованиях [1, 2, 6, 10, 15, 16].
Методом высокоразрешающего полногеномного сканирование при помощи SNP array была выявлена дупликация, расположенная в участке 5p13.3p13.2 (размером ~ 994 тыс. пн), она охватывала 11 генов, функции шести из которых известны и они индексированы в базе данных OMIM (Online Mendelian Inheritance in Men) (http://omim.org/) (рис. 2). Биоинформатический анализ показал, что эта дупликация, вероятно, является причинной задержки развития и врожденных пороков развития, наблюдаемых у пациента. Кроме того, это позволило нам определить молекулярный механизм геномной нестабильности, приводящей к развитию выявленной патологии центральной нервной системы.

Рис. 2. Схематическое изображение дупликации участка короткого плеча хромосомы 5, обнаруженной с помощью молекулярного кариотипирования с помощью геномного браузера UCSC (http://genome.ucsc.edu/)
В течение последних десятилетий в литературе было несколько сообщений о дупликации в участке 5p13. Молекулярно-цитогенетические исследования свидетельствуют, о том, что подобные дупликации вызывают синдром дупликации 5p13 (OMIM:613174) с участием гена NIPBL. Клинически данный синдром характеризуется задержкой развития и умственной отсталостью со следующими микроаномалиями лица: выступающие лобные бугры, большой или широкий лоб, короткие/наклонных глазные щели, высокое нёбо, и низкорасположенные ушные раковины [14]. Тем не менее, в данном случае дупликация не затронула критический участок синдрома дупликации 5p13. В базе данных DECIPHER v8.8 (https://decipher.sanger.ac.uk) было описано два случая с дупликацией, аналогичной перестройке у нашего пациента. Хотя у одного из пациентов отмечалась грубая задержка развития, в обоих случаях, похоже, наблюдались более легкие фенотипические появления по сравнению с описываемым нами пациентом. Фенотипические различия, вероятно, объясняются вариациями размеров исследуемого участка последовательностей ДНК. Для анализа корреляции генотип-фенотип мы использовали биоинформатический анализ [7].
При проведении микроматричного анализа (рис. 2) было выявлено шесть генов, которые были исследованы с помощью биоинформатического метода (для подробного описания использованных баз данных см. [7]). Ген TARS (OMIM:187790) кодирует различные формы аминоацил-тРНК-синтетазы и взаимодействует с многочисленными белками этого семейства. Показано, что другие функции при нарушении гена TARS могут быть связаны с расстройствами нервной системы и аутоиммунными заболеваниями. Ген ADAMTS12 (OMIM:606184) кодирует дезинтегрин и металлопротеиназу из семейства белков протромбоспондина, связанных с защитной от опухоли функцией, взаимодействуя с рядом генных продуктов, среди которых белки, вовлеченные в геномную сеть Notch (NOTCH1, FURIN). Функциональное изменение числа копий гена ADAMTS12 может быть связано с многочисленными патогенными процессами, включая те, которые ассоциированы с дисфункцией головного мозга, аутоиммунными, воспалительными и онкологическими заболеваниями. Ген RXFP3 (OMIM:609445) является частью семейства релаксин пептидных рецепторов. Биоинформатический анализ показал, что вариации числа копий гена RXFP3 может быть причиной изменения нейропептидов, организации нейроэндокринных сигналов и стимулирования усваивания воды и пищи. Ген SLC45A2 (OMIM:606202) кодирует белок, являющийся промежуточным звеном синтеза меланина, и он связан с альбинизмом IV типа (OMIM:606574). С помощью BioGPS было установлено, что этот ген активнее экспрессируется в сетчатке (http://biogps.org/#goto=genereport&id=51151). Ген AMACR (OMIM:604489) кодирует рацемозу и, вероятно, мутации гена во взрослом возрасте могут вызвать сенсомоторную нейропатию, пигментную ретинопатию, и адреномиелонейропатию из-за дефектов в синтезе желчных кислот. Кроме того, продукт этого гена взаимодействует с многофункциональными белками, которые играют роль в транскрипции и регуляции клеточного цикла, запрограммированной гибели клеток и поддержании стабильности генома. Ген C1QTNF3 (OMIM:612045) кодирует C1q и белок фактора некроза опухоли, мутации в котором связаны с заболеваниями нервной системы, приводящими к нарушению поведения. Продукт гена взаимодействует с лептином, который является элементом геномной сети, регулирующей размер тела, жировой запас, и может воздействовать на мозг, ингибируя потребление пищи.
Биоинформатический анализ генов, затронутых в дупликации, позволил нам предположить корреляцию генотип-фенотип. Таким образом, увеличение числа копий гена TARS, скорее всего, будет связано с задержкой развития и врожденными пороками развития; гена ADAMTS12 – с мозговой дисфункцией, а также с задержкой развития и врожденными пороками развития; гена RXFP3 – с неврологическими симптомами и снижением аппетита; гена SLC45A2 – с нарушением зрения; гена AMACR – с неврологическими симптомами, включая глухоту, нарушение зрения и другими врожденными пороками развития; гена C1QTNF3 – с задержкой роста и снижением аппетита.
Заключение
В настоящей работе дается описание случая дупликации короткого плеча хромосомы 5 в участке 5p13.3p13.2, ассоциированной с задержкой развития, врожденными пороками развития и CIN (спорадической анеуплоидией). Применение высокоразрешающего SNP микроматричного анализа, FISH исследования соматической анеуплоидии и биоинформатического метода исследования позволили провести корреляцию генотип-фенотип и выявить связь между регулярной дупликацией 5p13 и CIN (т.е. спорадической мозаичной анеуплоидией низкого уровня) у представляемого пациента. Таким образом, совместное использование методов, направленных на исследование индивидуальных и межклеточных вариации генома в сочетание с углублённым биоинформатическим анализом, может выявить патогенное значение этих вариаций и понять основную причину фенотипических вариаций геномных перестроек, связанных с механизмом заболевания в каждом конкретном случае (персонифицированная геномика).
Исследование выполнено за счет гранта Российского Научного Фонда (проект №14-15-00411).
Библиографическая ссылка
Ворсанова С.Г., Ворсанова С.Г., Ворсанова С.Г., Юров Ю.Б., Юров Ю.Б., Юров Ю.Б., Куринная О.С., Куринная О.С., Куринная О.С., Алямовская Г.А., Кешишян Е.С., Демидова И.А., Демидова И.А., Демидова И.А., Юров И.Ю., Юров И.Ю., Юров И.Ю. СТРУКТУРНАЯ ВАРИАЦИЯ ГЕНОМА В ВИДЕ МИКРОДУПЛИКАЦИИ КОРОТКОГО ПЛЕЧА ХРОМОСОМЫ 5, АССОЦИИРОВАННАЯ С МОЗАИЧНОЙ АНЕУПЛОИДИЕЙ // Международный журнал прикладных и фундаментальных исследований. 2015. № 9-1. С. 39-43;URL: https://applied-research.ru/ru/article/view?id=7435 (дата обращения: 21.01.2026).

