Ранее исследовано влияние перхлоратов замещенного пиридиния и некоторых неорганических катионов на анодное растворение цинка и сплавов ZnNi в боратном буфере. Показана целесообразность корреляции защитных эффектов соединений с характеристиками длинноволновой полосы поглощения ультрафиолетовой части электронного спектра их растворов [1]. Связь параметров селективного растворения сплавов с защитным эффектом органических соединений проанализирована в [2, 3]. Цель данной работы состояла в выяснении влияния перхлоратов замещенного пиридиния на электродные реакции, протекающие на цинке и сплавах ZnNi с высоким содержанием цинка в кислых сульфатных средах.
Материалы и методы исследования
Электрохимические измерения проводили при температуре 25 °С в трехэлектродной ячейке с разделенным катодным и анодным пространством с помощью потенциостата ПИ – 50-1.1. Рабочим электролитом служил насыщенный очищенным аргоном раствор 0,25М Na2SO4 + 0,005М H2SO4. В качестве электрода сравнения использовали насыщенный хлорсеребряный электрод ЭВП – 1М, противоэлектродом служила платина. Потенциалы приведены в работе относительно насыщенного хлорсеребряного электрода х.с.э.
Электроды из цинка (99,9 % Zn) и из сплавов ZnNi с содержанием цинка [Zn]0 = 95 и 80 мас. % зачищали абразивной бумагой, полировали, обезжиривали этанолом и предварительно поляризовали в течение 1 мин при Е = – 1,2 В. В качестве ингибиторов использовали перхлораты замещенного пиридиния, названия и молярные массы которых представлены в табл. 1.
Действие соединений оценивали коэффициентом торможения g = i0/i, где i0 и i – скорости процесса в чистом растворе и при наличии добавки соответственно. Концентрация добавок 0,1 ммоль/л.
Результаты исследования и их обсуждение
Цинк и сплав с его содержанием 95 % имеют одинаковые потенциалы коррозии (Екор) и скорости растворения при электроотрицательных потенциалах (Е), а при увеличении Е на 60 мВ их скорости начинают различаться. Рост концентрации никеля в сплаве до 20 % приводит к смещению Екор в анодную область на 320-400 мВ.
Введение в раствор перхлоратов замещенного пиридиния меняет скорость электродных реакций и не приводит к изменению вида поляризационных кривых. Значения коэффициентов торможения g и их зависимость от потенциала и природы добавок представлены в табл. 2.
Таблица 1
Названия и молярные массы исследованных соединений
|
№ п/п |
Название |
М |
|
1 |
Перхлорат 2,4,6 – триметил-N- (2`-аминофенил)пиридиния |
312,5 |
|
2 |
Перхлорат 2,4,6 – триметил-N- (3`-амино фенил)пиридиния |
312,5 |
|
3 |
Перхлорат 2,4,6 – триметил-N- (2`-бромфенил)пиридиния |
376,5 |
|
4 |
Перхлорат 2,4,6 – трифенил-N- (3`-аминофенил)пиридиния |
498,5 |
|
5 |
Перхлорат 2,4,6 – трифенил-N- (4` -аминофенил)пиридиния |
498,5 |
|
6 |
Перхлорат 2,4,6 – трифенил-N- (2` -бромфенил)пиридиния |
562,5 |
В случае чистого цинка перхлораты замещенного пиридиния уменьшают скорость обеих электродных реакций и являются ингибиторами смешанного типа. Величина защитного действия g в большинстве случаев с ростом Е уменьшается. Добавки различаются по влиянию на скорости катодной и анодной реакции в зависимости от состава сплава. Введение никеля в цинк приводит к снижению g всех ингибиторов и обратной их зависимости от Е по сравнению с чистым цинком. При увеличении концентрации никеля до 20 % наблюдается более сильное снижение защитного действия добавок 1-3, причем при электроотрицательных Е процесс ионизации сплава стимулируется. Остальные добавки ингибируют анодное растворение сплава 80Zn20Ni, но в меньшей степени, чем 95Zn5Ni.
Попытка провести корреляцию защитных эффектов соединений с характеристиками длинноволновой полосы поглощения ультрафиолетовой части электронного спектра их растворов не дала положительного результата. Возможна качественная оценка влияния природы заместителей в соединениях на их защитный эффект. Так, замена метильных радикалов на фенильные в положении 2, 4, 6 катиона пиридиния при прочих равных условиях приводит к уменьшению защитного действия на обе электродные реакции цинка и сплава 95Zn5Ni. В случае же сплава 80Zn20Ni большим защитным эффектом обладают ингибиторы с фенильными радикалами. Положение заместителя в фенильном радикале, связанном с атомом азота (аминогруппа в о- и м- положении, соединения 1 и 2) практически не влияет на защитный эффект добавок при растворении сплавов. В случае же катодного выделения водорода более предпочтительным для соединений 1, 2 и 6 является м- и п-положение соответственно.
Таблица 2
Зависимость g от природы добавки, потенциала и состава сплава
|
-Е,В |
Значения g для добавок |
|||||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
Катодная область, цинк |
||||||
|
1,4 |
1,36 |
1,58 |
1,45 |
1,39 |
1,21 |
1,34 |
|
1,2 |
1,42 |
2,14 |
1,32 |
1,5 |
1,36 |
1,42 |
|
1,1 |
1,5 |
2,2 |
1,76 |
1,91 |
1,62 |
1,83 |
|
Анодная область |
||||||
|
0,90 |
5,76 |
5,76 |
5,75 |
3,02 |
5,51 |
4,35 |
|
0,85 |
3,62 |
3,62 |
3,31 |
1,92 |
4,46 |
3,79 |
|
0,80 |
2,89 |
2,94 |
3,01 |
1.66 |
3,98 |
4,18 |
|
Катодная область, сплав 95Zn5Ni |
||||||
|
1,4 |
2,8 |
1,64 |
0,7 |
1,51 |
0,99 |
1,07 |
|
1,2 |
2,7 |
1,81 |
1,15 |
3,12 |
1,0 |
0,81 |
|
1,1 |
2,6 |
1,33 |
0,90 |
2,21 |
1,0 |
0,67 |
|
Анодная область |
||||||
|
0,9 |
1,99 |
4,81 |
2,09 |
1,51 |
1,31 |
1,18 |
|
0,8 |
1,58 |
1,65 |
2,18 |
1,82 |
1,25 |
1,20 |
|
0,5 |
2,08 |
2,18 |
2,80 |
2,13 |
1,44 |
1,58 |
|
0,4 |
2,08 |
1,99 |
3,16 |
2,88 |
1,81 |
1,81 |
|
0,3 |
2,08 |
2,08 |
3,46 |
3,81 |
2,29 |
2,39 |
|
Катодная область, сплав 80Zn20Ni |
||||||
|
0,90 |
1,15 |
3,60 |
1,69 |
1,41 |
0,82 |
0,60 |
|
0,85 |
1,10 |
4,71 |
1,18 |
2,10 |
1,10 |
0,95 |
|
0,80 |
1,10 |
5,62 |
0,89 |
2,80 |
1,60 |
1,52 |
|
0,75 |
0,80 |
7,49 |
0,60 |
1,63 |
1,24 |
1,82 |
|
Анодная область |
||||||
|
0,60 |
0,43 |
1,05 |
1,0 |
2,29 |
1,25 |
3,10 |
|
0,50 |
0,83 |
0,95 |
1,0 |
2,88 |
1,15 |
1,26 |
|
0,40 |
0,85 |
1,0 |
0,91 |
3,31 |
1,05 |
1,15 |
|
0,30 |
1,14 |
0,76 |
1,24 |
3,46 |
0,96 |
1,0 |
Исследованные сплавы склонны к селективному растворению с фазовой перегруппировкой в поверхностном слое, поскольку равновесные потенциалы их компонентов существенно различаются. Об этом также свидетельствуют литературные данные, полученные при изучении закономерностей растворения сплавов ZnNi с высоким с средним содержанием цинка [4-7].
Хроноамперограммы сплавов характеризуются спадом тока во времени t до некоторого минимального значения (imin при tрп), затем наступает незначительная его стабилизация, после чего наблюдается рост, вызванный фазовой перегруппировкой и развитием поверхности электрода. В некоторых случаях ток достигает предельной величины (imax) при значениях tmax.
Установлено, что растворение сплавов протекает в условиях смешанной кинетики. Количественные характеристики растворения сплавов получены из i,t – кривых, перестроенных в соответствии с уравнением (1) [3], в координатах i-t1/2:
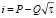 (1)
(1)
Значения параметров Р, Q, imin, tрп, imax, tmax, а также эффективные коэффициенты твердофазной диффузии (DZn = 4P4/p(2F[Zn]0Q)2), определенные на линейных участках в начальные промежутки времени приведены в табл. 3.
Таблица 3
Значения параметров растворения сплавов
|
Параметр* |
Значения параметров при -Е,В |
||||
|
0,98 |
0,96 |
0,90 |
0,60 |
0,56 |
|
|
сплав 95Zn5Ni |
Zn80Ni20 |
||||
|
Р×103, мА/см2 (0) |
0,26 |
0,52 |
2,02 |
1,4 |
2,05 |
|
Р×103,мА/см2 (2) |
0,34 |
0,64 |
2,39 |
1,36 |
2,2/2,37 |
|
Р×103, мА/см2 (4) |
0,31 |
0,25 |
1,50 |
1,33 |
2,37 |
|
Q×105, мА/см2с1/2 (0) |
1,10 |
3,82 |
0,51 |
0,96 |
0,7 |
|
Q×105, мА/см2с1/2 (2) |
0,80 |
1,40 |
1,12 |
0,58 |
2,53 |
|
Q×105, мА/см2с1/2(4) |
0,52 |
0,10 |
0,60 |
1,33 |
1,82 |
|
D×1011, cм2/с (0) |
0,005 |
0,007 |
0,91 |
7,64 |
184 |
|
D×1011 ,cм2/с (2) |
0,025 |
0,37 |
0,37 |
58,6 |
21,1/100** |
|
D×1011 ,cм2/с (4) |
0,047 |
0,48 |
19,4 |
3,24 |
17,29 |
Примечания. * Цифры в скобках – номера добавок. ** Два значения параметра обусловлены наличием двух линейных участков на кривых.
Коэффициент диффузии D, параметры Р и Q растут при увеличении потенциала и содержания цинка в сплаве. Производные пиридиния изменяют критериальные характеристики на хроноамперограммах. Снижая скорость процесса, они в большинстве случаев сокращают время развития поверхности и способствуют развитию поверхности, табл. 4.
Таблица 4
Значения характеристических параметров при растворении сплава 80Zn20Ni
|
№ добавки |
Значения параметров при потенциалах -Е, В |
||||||||
|
0.60 |
0.56 |
0.54 |
|||||||
|
tрп / iрп |
tmin/ imin |
tmax/ imax |
tрп/ iрп |
tmin / imin |
tmax/ imax |
tрп / iрп |
tmin/ imin |
tmаx/ imax |
|
|
0 |
32/1,13 |
34/1,13 |
43/1,20 |
28/2,46 |
30/2,45 |
43/2,51 |
33/4,15 |
35/4,12 |
42/4,25 |
|
2 |
27/1,13 |
30/1,13 |
43/1,22 |
25/2,02 |
30/1,99 |
43/2,11 |
28/3,21 |
30/3,17 |
38/3,37 |
|
4 |
7/1,85 |
8/1,82 |
18/1,94 |
7/2,35 |
10/2,32 |
25/2,41 |
11/3,72 |
18/3,65 |
30/3,82 |
Примечание. Токи даны в мА/см2, время – в секундах.
Поскольку растворение сплавов протекает в условиях смешанной кинетики, то можно разделить влияние добавок на стадии процесса: жидкофазную и твердофазную диффузию. В согласии с [3], рассчитаны коэффициенты влияния добавок на жидкофазную (gж = Р/Ри) и твердофазную диффузию (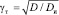 ), табл. 5.
), табл. 5.
Таблица 5
Зависимость g от природы ПАВ, состава сплава и Е
При более электроотрицательных Е добавки преимущественно влияют на жидкофазную диффузию, а при увеличении анодной поляризации – на твердофазную диффузию.
Выводы
1. Исследованные замещенные перхлораты пиридиния являются ингибиторами смешанного типа для обеих электродных реакций, протекающих на цинке. Введение никеля и увеличение его концентрации ведет к снижению тормозящего действия добавок на скорость катодного выделения водорода. Добавки 1-3 стимулируют анодное растворения сплава 80Zn20Ni.
2. Селективное растворение сплавов сопровождается фазовой перегруппировкой в поверхностном слое. Исследованные добавки не подавляют фазовой перегруппировки, а лишь по-разному влияют на конкурирующие факторы: снижение скорости процесса из-за селективного растворения и ее рост из-за фазовых превращений и развития поверхности.
3. Селективное растворение сплавов протекает в условиях смешанной кинетики, добавки в большинстве случаев преимущественно влияют на стационарную жидкофазную диффузию.
|
№ добавки |
Значения g для сплава 80Zn20Ni при потенциалах -Е, В |
|||||
|
0.56 |
0.54 |
0.40 |
||||
|
gж |
gт |
gж |
gт |
gж |
gт |
|
|
2 |
1,2 |
2,93 |
1,25 |
3,48 |
1,0 |
2,90 |
|
4 |
1,02 |
4,76 |
1,10 |
2,58 |
0,77 |
0,34 |
|
Сплав 95Zn5Ni при -Е,В |
||||||
|
0,98 |
0,96 |
0,90 |
||||
|
2 |
0,78 |
0,42 |
0,81 |
0,13 |
0,84 |
1,57 |
|
4 |
0,85 |
0,30 |
2,10 |
0,12 |
1,34 |
2,17 |
Библиографическая ссылка
Бережная А.Г., Чернявина В.В. ПЕРХЛОРАТЫ ЗАМЕЩЕННОГО ПИРИДИНИЯ КАК РЕГУЛЯТОРЫ СКОРОСТЕЙ ЭЛЕКТРОДНЫХ РЕАКЦИЙ НА ЦИНКЕ И СПЛАВАХ НА ЕГО ОСНОВЕ // Международный журнал прикладных и фундаментальных исследований. 2015. № 12-8. С. 1402-1405;URL: https://applied-research.ru/ru/article/view?id=8159 (дата обращения: 03.03.2026).

