Актуальной задачей современности является повышение степени эффективности извлечение тяжелых металлов из сточных вод. Известно, что тяжелые металлы являются стойкими химическими загрязнителями, обладающие специфическими токсическими свойствами. В сточных водах, а также в природных подземных водах, как правило, содержатся соединения марганца [2].
При очистке сточных вод от ионов цветных и тяжелых металлов практическая задача заключается в подборе местных природных материалов. В связи с этим целью настоящей работы явилось изучение сорбционной способности каолинита при извлечении ионов марганца из водных растворов.
Материалы и методы исследования
Исследована сорбционная способность каолинита по отношению к ионам марганца (II) на природном сорбенте. Для изучения процесса сорбции использовали природный минерал – каолинит. Для исследования брали фракцию каолинита с размером частиц 2,5÷3,5 мм.
Эксперимент проводили при температурах 298, 318 и 333 К. Сорбцию ионов марганца на каолините изучали в статических условиях из нитратных растворов с концентрациями от 0,05 М до 0,16 М. Сорбент в количестве 1 г заливали 50 мл растворами. Контакт сорбента с раствором продолжался до установления равновесия в течение 7 суток [6]. Затем сорбент и раствор отделяли и анализировали на содержания ионов марганца и измеряли рН среды. Концентрацию ионов марганца в растворе определяли по методике [5].
Количество вещества, сорбированного единицей массы сорбента Г, ммоль/г, рассчитывали по формуле:
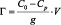 ,
,
где С0 – концентрация марганца в исходном растворе, ммоль/л; Ср – равновесная (остаточная) концентрация извлекаемого иона марганца в растворе, ммоль/л; V – объем раствора, мл; g – масса сорбента, г.
По полученным результатам строили изотермы сорбции, дающие основные сведения о сорбционных свойствах материала и характере сорбции на нем определенных веществ.
Результаты исследования и их обсуждение
Перед рассмотрением и анализом экспериментальных данных по изучению основных закономерностей сорбции ионов Mn (II), рассмотрим ионное состояние исходных растворов. В водных растворах свободные ионы марганца (II) практически не существуют вследствие сильной гидратации. При образовании исходных растворов нитратов марганца происходит гидратообразование с выделением плохо растворимого гидроксида Mn(OH)2, а также гидролиз ионов марганца. Оба этих эффекта способны оказывать влияние на результаты сорбции. В 1М растворах начальная величина водородного показателя среды при начале гидратообразования рНгидр. для Mn2+ равна 7,8 [4], в случае 0,01М растворов Mn2+ 8,8 [4], а при полном осаждении, где автор принимает концентрацию 10–5 М, рНгидр. составляет 10,4 [4].
В связи со снижением в процессе сорбции концентраций Mn2+, гидролизующихся по уравнению
Mn 2+ + HOH ↔ MnOH+ + H+ ,
происходит непрерывное изменение водородного показателя среды. Величина рН может быть рассчитана из зависимости (КW = 10-14)
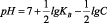 ,
,
где lgKВ и С – соответственно константа диссоциации слабого основания, образующего соль по второй ступени, равная для Mn(OH)2 (5·10-4) [4]. Результаты расчетов показали, что по мере снижения содержания ионов Mn2+ рН раствора существенно возрастает. Эти данные подтверждают и экспериментальные измерения рН растворов до и после сорбции ионов марганца (II) на каолините (рис. 1).
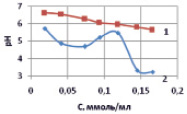
Рис. 1. Зависимость рН раствора нитрата марганца от концентрации ионов Mn (II): исходных растворов до сорбции (1) и растворов после сорбции (2)
Для установления закономерностей сорбции ионов марганца (II) на каолините было изучено влияние концентрации исходного раствора и температуры на величину сорбции. В результате было установлено, что с увеличением концентрации ионов марганца (II) возрастает величина удельной сорбции. Полученные данные показывают, что сорбционная емкость при температуре 298 К составляет 0,031 ммоль/г; при 318 К – 0,063 ммоль/г и при 333 К – 0,075 ммоль/г. Таким образом, сорбционная емкость возрастает с ростом температуры.
В результате сорбции наблюдается конкуренция двух видов межмолекулярных взаимодействий: гидратация ионов металлов и взаимодействие ионов металлов с сорбентом [1]. С увеличением концентрации сорбция на исходном каолините возрастает и в области 0,1 ммоль/мл наблюдается перегиб (рис. 2), указывающий на изменение механизма сорбции. На первой ступени сорбции марганца предельное значение не достигается и выше отмеченной концентрации сорбция проходит одновременно на различных активных центрах. Сорбция проходит по ионообменному механизму по схеме:
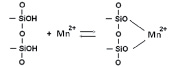
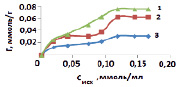
Рис. 2. Зависимость сорбции ионов марганца из растворов нитрата марганца (II) на каолините при температуре, К: 1 – 298, 2 – 318, 3 – 333
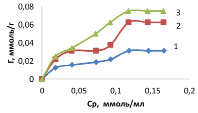
Рис. 3. Изотермы сорбции ионов марганца на каолините при температуре, К: 1 – 298; 2 – 318; 3 – 333
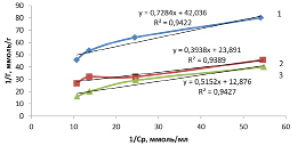
Рис. 4. Изотерма сорбции ионов марганца (вторая ступень) в линейных координатах уравнения Ленгмюра при температуре: 1 – 298; 2 – 318; 3 – 333
Расчеты изотерм сорбции ионов марганца на каолините
|
Температура, К |
1 ступень |
2 ступень |
||||
|
Г∞, ммоль/г |
КL, г/ммоль |
R2 |
Г∞, ммоль/г |
КL, г/ммоль |
R2 |
|
|
298 |
8,33 |
46,25 |
1,0 |
1,37 |
57,57 |
0,942 |
|
318 |
11,38 |
39,59 |
0,992 |
2,54 |
60,79 |
0,938 |
|
333 |
1,94 |
0,15 |
0,943 |
1,96 |
24,99 |
0,942 |
На второй ступени сорбции ионов марганца (II) также происходит по ионообменному механизму, но на менее доступных активных центрах, находящихся в участках каолинита с более высокой степенью дисперсности.
Изотермы сорбции ионов марганца (II) (рис. 3) принадлежат к изотермам IV типа по классификации БЭТ [3], которым характерна конечная адсорбция при приближении к насыщению концентрации.
Выявление сорбционных параметров предельной удельной сорбции Г∞ и константы, указывающей на сродство сорбата к сорбенту, проведено обработкой результатов в соответствии с линейной формой уравнения Ленгмюра [2]:
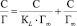 ,
,
где Г∞ – предельная емкость сорбента, ммоль/г; Г – количество сорбированных ионов Mn2+, ммоль/г; КL – константа сорбционного взаимодействия, характеризующая интенсивность сорбции, л/ммоль, С – равновесная концентрация, ммоль/л.
Линейная изотерма (рис. 4) позволяет графически определить оба постоянных параметра сорбционной изотермы Лэнгмюра (Г∞ и КL). Экстраполяция прямолинейной изотермы до оси ординат дает отрезок, равный 1/(Г∞·КL), а тангенс угла наклона прямой tg∞ = 1/Г∞ [7]. Рассчитанные значения постоянных уравнения Лэнгмюра приведены в таблице.
Параметр сорбционного взаимодействия (КL) характеризует энергию взаимодействия сорбата с сорбентом. Чем сильнее это взаимодействие, тем больше его величина. Как видно из таблицы, что чем выше температура процесса, тем больше ослабевает взаимодействие сорбата с сорбентом.
Заключение
Установлено, что каолинит обладает высокой сорбционной способностью по отношению к ионам марганца. Изотермы сорбции ионов марганца (II) в широком интервале концентраций раствора нитрата марганца подчиняется уравнению Ленгмюра; рассчитаны предельные значения сорбции.
Библиографическая ссылка
Пимнева Л.А., Королева М.Н., Казанцева А.В. ЗАКОНОМЕРНОСТИ СОРБЦИИ ИОНОВ МАРГАНЦА (II) КАОЛИНИТОМ // Международный журнал прикладных и фундаментальных исследований. 2016. № 4-3. С. 545-547;URL: https://applied-research.ru/ru/article/view?id=9009 (дата обращения: 03.02.2026).

